نیتروژن یک عنصر شیمیایی است . دارای نماد N و عدد اتمی 7 است. نیتروژن یک نافلز و سبک ترین عضو گروه 15 جدول تناوبی است که اغلب به آن پنیکتوژن می گویند . این عنصر رایج در کیهان است که در کهکشان راه شیری و منظومه شمسی در رتبه هفتم فراوانی کلی قرار دارد . در دما و فشار استاندارد ، دو اتم عنصر به هم متصل میشوند تا N 2 ، یک گاز دو اتمی بیرنگ و بیبو را تشکیل دهند . N 2 حدود 78 درصد جو زمین را تشکیل می دهد و آن را به فراوان ترین گونه شیمیایی در هوا تبدیل می کند. به دلیل فرار ترکیبات نیتروژن، نیتروژن در قسمت های جامد زمین نسبتاً کمیاب است.
اولین بار توسط پزشک اسکاتلندی دانیل رادرفورد در سال 1772 و بطور مستقل توسط کارل ویلهلم شیله و هنری کاوندیش در همان زمان کشف و جدا شد . نام نیتروژن توسط شیمیدان فرانسوی Jean-Antoine-Claude Chaptal در سال 1790 پیشنهاد شد ، زمانی که مشخص شد نیتروژن در اسید نیتریک و نیترات ها وجود دارد . آنتوان لاووازیه به جای آن نام آزوت را از یونانی باستان پیشنهاد کرد : ἀζωτικός "بدون زندگی"، زیرا یک گاز خفه کننده است . این نام در تعدادی از زبان ها استفاده می شود و در نام انگلیسی برخی از ترکیبات نیتروژن مانند هیدرازین ، آزیدها و ترکیبات آزو آمده است .
نیتروژن عنصری معمولاً با فناوری جذب نوسان فشار از هوا تولید می شود . حدود 2/3 از نیتروژن عنصری تولید شده تجاری به عنوان یک گاز بی اثر (بدون اکسیژن) برای مصارف تجاری مانند بسته بندی مواد غذایی استفاده می شود و بسیاری از بقیه به عنوان نیتروژن مایع در کاربردهای برودتی استفاده می شود . بسیاری از ترکیبات مهم صنعتی مانند آمونیاک ، اسید نیتریک، نیترات های آلی ( مواد پیشران و مواد منفجره ) و سیانیدها حاوی نیتروژن هستند. پیوند سه گانه بسیار قوی در نیتروژن عنصری (N≡N)، دومین پیوند قوی در هر مولکول دو اتمی پس از مونوکسید کربن (CO)، [8] بر شیمی نیتروژن غالب است. این امر هم برای ارگانیسم ها و هم برای صنعت در تبدیل N 2 به ترکیبات مفید مشکل ایجاد می کند ، اما در عین حال به این معنی است که سوزاندن، انفجار یا تجزیه ترکیبات نیتروژن برای تشکیل گاز نیتروژن، مقادیر زیادی انرژی اغلب مفید آزاد می کند. آمونیاک و نیترات های مصنوعی تولید شده از کودهای صنعتی کلیدی هستند و نیترات های کود آلاینده های کلیدی در اوتروفیکاسیون سیستم های آبی هستند. جدا از کاربرد آن در کودها و ذخایر انرژی، نیتروژن جزء ترکیبات آلی متنوعی مانند آرامیدهای مورد استفاده در پارچه های با استحکام بالا و سیانواکریلات مورد استفاده در سوپرچسب است .
نیتروژن در همه موجودات، عمدتاً در اسیدهای آمینه (و در نتیجه پروتئین ها )، در اسیدهای نوکلئیک ( DNA و RNA ) و در مولکول انتقال انرژی آدنوزین تری فسفات وجود دارد . بدن انسان حاوی حدود 3 درصد نیتروژن جرمی است که چهارمین عنصر فراوان در بدن پس از اکسیژن، کربن و هیدروژن است. چرخه نیتروژن حرکت عنصر از هوا، به بیوسفر و ترکیبات آلی و سپس بازگشت به جو را توصیف می کند. نیتروژن جزء تشکیل دهنده هر گروه دارویی عمده دارویی از جمله آنتی بیوتیک ها است . بسیاری از داروها تقلید یا پیش داروی مولکول های سیگنال طبیعی حاوی نیتروژن هستند : برای مثال، نیترات های آلی نیتروگلیسیرین و نیتروپروساید با متابولیزه شدن به اکسید نیتریک فشار خون را کنترل می کنند . بسیاری از داروهای حاوی نیتروژن قابل توجه، مانند کافئین طبیعی و مورفین یا آمفتامین های مصنوعی ، بر گیرنده های انتقال دهنده های عصبی حیوانی اثر می گذارند .

ترکیبات نیتروژن تاریخچه بسیار طولانی دارند، کلرید آمونیوم برای هرودوت شناخته شده است . آنها در قرون وسطی به خوبی شناخته شده بودند. کیمیاگران اسید نیتریک را با نام aqua fortis (آب قوی) و همچنین سایر ترکیبات نیتروژن مانند نمک های آمونیوم و نمک های نیترات می شناسند . مخلوط اسیدهای نیتریک و هیدروکلریک به عنوان aqua regia (آب سلطنتی) شناخته می شد که به دلیل توانایی آن در حل کردن طلا ، پادشاه فلزات، مشهور بود. [9]
کشف نیتروژن به پزشک اسکاتلندی دانیل رادرفورد در سال 1772 نسبت داده می شود که آن را هوای مضر نامید . [10] [11] اگرچه او آن را به عنوان یک ماده شیمیایی کاملاً متفاوت تشخیص نداد، اما به وضوح آن را از "هوای ثابت" جوزف بلک یا دی اکسید کربن متمایز کرد. [12] این واقعیت که یک جزء از هوا وجود دارد که از احتراق پشتیبانی نمی کند، برای رادرفورد واضح بود، اگرچه او نمی دانست که آن یک عنصر است. نیتروژن نیز تقریباً در همان زمان توسط کارل ویلهلم شیل ، [13] هنری کاوندیش ، [14] و جوزف پریستلی ، [15] مورد مطالعه قرار گرفت که از آن به عنوان هوای سوخته یا هوای phlogisticed یاد کردند . شیمیدان فرانسوی، آنتوان لاووازیه، گاز نیتروژن را به دلیل خفگی بودن ، از کلمه یونانی άζωτικός (azotikos) به نام "هوای مفیتیک" یا آزوت نامیده است . [16] [17] در فضایی از نیتروژن خالص، حیوانات می مردند و شعله های آتش خاموش می شد. اگرچه نام لاووازیه در انگلیسی پذیرفته نشد زیرا اشاره شد که همه گازها به جز اکسیژن یا خفه کننده هستند یا کاملاً سمی، اما در بسیاری از زبان ها (فرانسوی، ایتالیایی، پرتغالی، لهستانی، روسی، آلبانیایی، ترکی و غیره) استفاده می شود. آلمانی Stickstoff به طور مشابه به همان ویژگی اشاره دارد، یعنی ersticken "خفه کردن یا خفه کردن") و هنوز در نام های رایج بسیاری از ترکیبات نیتروژن مانند هیدرازین و ترکیبات یون آزید باقی می ماند . در نهایت، به نام " پنیکتوژن " برای گروهی که نیتروژن در راس آن قرار دارد، از یونانی πνίγειν "خفه کردن" منتهی شد. [9]
کلمه انگلیسی نیتروژن (1794) از نیتروژن فرانسوی وارد زبان شد که در سال 1790 توسط شیمیدان فرانسوی ژان آنتوان شاپتال (1756-1832) ابداع شد، [18] از نیتر فرانسوی ( نیترات پتاسیم ، همچنین به نام نمک نمکی ) و پسوند فرانسوی. -gène ، "تولید کننده" از یونانی -γενής (-genes، "زاییده"). منظور چپال این بود که نیتروژن جزء ضروری اسید نیتریک است که به نوبه خود از نیتر تولید می شود . در زمانهای پیشین، نیتر با «ناترون» مصری ( کربنات سدیم ) - که در یونانی νίτρον (نیترون) نامیده میشود - اشتباه گرفته میشد که علیرغم نام، حاوی نیترات نبود. [19]
اولین کاربردهای نظامی، صنعتی و کشاورزی ترکیبات نیتروژن از نمک نمک ( نیترات سدیم یا نیترات پتاسیم)، به ویژه در باروت و بعداً به عنوان کود استفاده می شد . در سال 1910، لرد ریلی کشف کرد که یک تخلیه الکتریکی در گاز نیتروژن، "نیتروژن فعال" را تولید می کند که یک آلوتروپ تک اتمی نیتروژن است. [20] "ابر چرخان نور زرد درخشان" تولید شده توسط دستگاه او با جیوه واکنش داد تا نیترید جیوه انفجاری تولید کند . [21]
برای مدت طولانی، منابع ترکیبات نیتروژن محدود بود. منابع طبیعی یا از زیست شناسی یا ذخایر نیترات های تولید شده توسط واکنش های جوی سرچشمه می گیرند. تثبیت نیتروژن توسط فرآیندهای صنعتی مانند فرآیند فرانک-کارو (1895-1899) و فرآیند هابر-بوش (1908-1913) این کمبود ترکیبات نیتروژن را کاهش داد، تا جایی که نیمی از تولید جهانی غذا در حال حاضر به کودهای نیتروژن مصنوعی متکی است. [22] در همان زمان، استفاده از فرآیند استوالد (1902) برای تولید نیتراتها از تثبیت نیتروژن صنعتی، امکان تولید صنعتی در مقیاس بزرگ نیتراتها را به عنوان ماده اولیه در ساخت مواد منفجره در جنگهای جهانی قرن بیستم فراهم کرد. [23] [24]

یک اتم نیتروژن دارای هفت الکترون است. در حالت پایه، آنها در پیکربندی الکترونی 1 قرار دارند2
2 ثانیه2
2p1
x2p1
سال2p1
z. بنابراین، دارای پنج الکترون ظرفیتی در اوربیتالهای 2s و 2p است که سه تای آن (الکترونهای p) جفت نشدهاند. این یکی از بالاترین الکترونگاتیوها را در بین عناصر دارد (3.04 در مقیاس Pauling)، که تنها توسط کلر (3.16)، اکسیژن (3.44) و فلوئور (3.98) فراتر رفته است. ( گازهای نجیب سبک ، هلیوم ، نئون ، و آرگون نیز احتمالاً الکترونگاتیوتر هستند، و در واقع در مقیاس آلن هستند.) [25] به دنبال روندهای تناوبی، شعاع کووالانسی تک پیوندی آن 71 pm کوچکتر از آن است . بور (84 pm) و کربن (76 pm) است ، در حالی که بزرگتر از اکسیژن (66 pm) و فلوئور (57 pm) است. آنیون نیترید ، N 3- ، در ساعت 146 بعد از ظهر بسیار بزرگتر است، شبیه به آنیون های اکسید (O2- : 140 pm) و فلوراید (F- : 133 pm). [25] سه انرژی یونیزاسیون اول نیتروژن 1.402، 2.856 و 4.577 MJ·mol -1 است و مجموع انرژی چهارم و پنجم برابر است با16.920 MJ·mol -1 . با توجه به این ارقام بسیار بالا، نیتروژن شیمی کاتیونی ساده ای ندارد. [26]
فقدان گره های شعاعی در زیر پوسته 2p مستقیماً مسئول بسیاری از خواص غیرعادی ردیف اول بلوک p است ، به ویژه در نیتروژن، اکسیژن و فلوئور. زیر پوسته 2p بسیار کوچک است و شعاع بسیار مشابهی با پوسته 2s دارد که هیبریداسیون مداری را تسهیل می کند . همچنین منجر به نیروهای جاذبه الکترواستاتیک بسیار بزرگ بین هسته و الکترون های ظرفیت در پوسته های 2s و 2p می شود که در نتیجه الکترونگاتیوی بسیار بالایی ایجاد می کند. به همین دلیل، بیش ظرفیتی در عناصر 2p تقریباً ناشناخته است، زیرا الکترونگاتیوی بالا باعث میشود یک اتم نیتروژن کوچک به عنوان اتم مرکزی در یک پیوند چهار الکترونی سه مرکزی غنی از الکترون دشوار باشد زیرا تمایل به جذب الکترون دارد. به شدت به خودش بنابراین، علیرغم موقعیت نیتروژن در رأس گروه 15 در جدول تناوبی، شیمی شیمیایی آن تفاوت های زیادی را با همزادهای سنگین ترش فسفر ، آرسنیک ، آنتیموان و بیسموت نشان می دهد . [27]
نیتروژن ممکن است به طور مفیدی با کربن و اکسیژن همسایگان افقی خود و همچنین همسایگان عمودی آن در ستون پنیکتوژن، فسفر، آرسنیک، آنتیموان و بیسموت مقایسه شود. اگرچه هر عنصر پریود 2 از لیتیوم تا اکسیژن شباهت هایی به عنصر دوره 3 در گروه بعدی نشان می دهد (از منیزیم تا کلر که به عنوان روابط مورب شناخته می شوند )، درجه آنها به طور ناگهانی از جفت بور-سیلیکون افت می کند. شباهت های نیتروژن به گوگرد بیشتر به ترکیبات حلقه نیترید گوگرد محدود می شود، زمانی که هر دو عنصر تنها موجود باشند. [28]
نیتروژن تمایل کربن برای کاتناسیون را ندارد . مانند کربن، نیتروژن تمایل به تشکیل ترکیبات یونی یا فلزی با فلزات دارد. نیتروژن یک سری گسترده از نیتریدها را با کربن تشکیل می دهد، از جمله آنهایی که ساختارهای زنجیره ای، گرافیتی و فولرنیک دارند. [29]
با الکترونگاتیوی بالا و قابلیت همزمان برای پیوند هیدروژنی و توانایی تشکیل کمپلکس های هماهنگی با اهدای جفت الکترون های خود شبیه اکسیژن است. شباهت هایی بین شیمی آمونیاک NH 3 و آب H 2 O وجود دارد. به عنوان مثال، ظرفیت هر دو ترکیب برای تولید NH 4 + و H 3 O + یا پروتونه زدایی برای تولید NH 2 - و OH - با همه اینها می توانند در ترکیبات جامد جدا شوند. [30]
نیتروژن با هر دو همسایه افقی خود ترجیحی برای تشکیل پیوندهای متعدد، معمولاً با کربن، اکسیژن، یا سایر اتم های نیتروژن، از طریق برهمکنش های p π - p π دارد . [28] بنابراین، به عنوان مثال، نیتروژن به عنوان مولکول های دو اتمی رخ می دهد و بنابراین دارای نقطه ذوب بسیار پایین تری (210- درجه سانتی گراد) و نقطه جوش (-196 درجه سانتی گراد) نسبت به بقیه گروه خود است، زیرا مولکول های N 2 فقط نگه داشته می شوند. همراه با برهمکنش های ضعیف واندروالس و الکترون های بسیار کمی برای ایجاد دوقطبی های آنی قابل توجه وجود دارد. این برای همسایگان عمودی آن ممکن نیست. بنابراین، اکسیدهای نیتروژن ، نیتریتها ، نیتراتها ، ترکیبات نیترو ، نیتروزو ، آزو و دیازو ، آزیدها ، سیاناتها ، تیوسیاناتها و مشتقات ایمنو هیچ انعکاسی با فسفر، آرسنیک، آنتیموان یا بیسموت پیدا نمیکنند. با این حال، پیچیدگی اکسواسیدهای فسفر با نیتروژن همخوانی ندارد. [28] با کنار گذاشتن تفاوتهایشان، نیتروژن و فسفر مجموعهای از ترکیبات را با یکدیگر تشکیل میدهند. اینها ساختارهای زنجیره ای، حلقه ای و قفسی دارند. [31]
جدول خواص حرارتی و فیزیکی نیتروژن (N 2 ) در فشار اتمسفر: [32] [33]

نیتروژن دو ایزوتوپ پایدار دارد : 14 نیتروژن و 15 نیتروژن. اولین ایزوتوپ بسیار رایج تر است و 99.634 درصد نیتروژن طبیعی را تشکیل می دهد و دومی (که کمی سنگین تر است) 0.366 درصد باقی مانده را تشکیل می دهد. این منجر به وزن اتمی در حدود 14.007 u می شود. [25] هر دوی این ایزوتوپهای پایدار در چرخه CNO در ستارگان تولید میشوند ، اما 14N رایجتر است زیرا جذب پروتون آن مرحله محدودکننده سرعت است. 14 N یکی از پنج هسته پایدار فرد-فرد است (نوکلیدی دارای تعداد فرد پروتون و نوترون). چهار مورد دیگر 2 H ، 6 Li، 10 B و 180m Ta هستند. [34]
فراوانی نسبی 14 نیوتن و 15 نیوتن عملاً در اتمسفر ثابت است، اما می تواند در جاهای دیگر متفاوت باشد، به دلیل شکنش طبیعی ایزوتوپی ناشی از واکنش های ردوکس بیولوژیکی و تبخیر آمونیاک طبیعی یا اسید نیتریک . [35] واکنشهای با واسطه بیولوژیکی (مانند جذب ، نیتریفیکاسیون ، و نیترات زدایی ) به شدت دینامیک نیتروژن در خاک را کنترل میکنند. این واکنش ها معمولاً منجر به غنی سازی 15 نیوتن بستر و تخلیه محصول می شود . [36]
ایزوتوپ سنگین 15 N اولین بار توسط SM Naudé در سال 1929 کشف شد و اندکی بعد ایزوتوپ های سنگین عناصر همسایه اکسیژن و کربن کشف شد. [37] این یکی از پایین ترین سطح مقطع جذب نوترون حرارتی را در بین تمام ایزوتوپ ها ارائه می دهد. [38] اغلب در طیفسنجی تشدید مغناطیسی هستهای (NMR) برای تعیین ساختار مولکولهای حاوی نیتروژن استفاده میشود، زیرا اسپین هستهای کسری آن نصف است، که مزایایی را برای NMR مانند عرض خط باریکتر ارائه میدهد. 14 N، اگرچه از نظر تئوری نیز قابل استفاده است، دارای یک عدد صحیح اسپین هسته ای است و بنابراین دارای یک گشتاور چهار قطبی است که منجر به طیف گسترده تر و کمتر مفید می شود. [25] 15 NMR با این وجود دارای عوارضی است که در طیفسنجی NMR 1H و 13C رایجتر دیده نمیشود . فراوانی طبیعی کم 15 نیوتن (0.36٪) به طور قابل توجهی حساسیت را کاهش می دهد، مشکلی که تنها با نسبت ژیرو مغناطیسی پایین آن تشدید می شود (تنها 10.14٪ نسبت 1 H). در نتیجه، نسبت سیگنال به نویز برای 1 H حدود 300 برابر بیشتر از 15 نیوتن با شدت میدان مغناطیسی یکسان است. [39] این ممکن است تا حدودی با غنی سازی ایزوتوپی 15 نیوتن بوسیله تبادل شیمیایی یا تقطیر جزئی کاهش یابد . 15 ترکیبات غنی شده با N این مزیت را دارند که در شرایط استاندارد، برخلاف ترکیبات دارای ایزوتوپ های هیدروژن ، کربن و اکسیژن که باید از اتمسفر دور نگه داشته شوند ، مبادله شیمیایی اتم های نیتروژن خود با نیتروژن اتمسفر انجام نمی دهند . [25] نسبت 15 N: 14 N معمولاً در تجزیه و تحلیل ایزوتوپ های پایدار در زمینه های ژئوشیمی ، هیدرولوژی ، دیرینه اقلیم شناسی و دیرین اقیانوس شناسی استفاده می شود، جایی که به آن δ 15 N می گویند . [40]
از سیزده ایزوتوپ دیگر تولید شده به صورت مصنوعی، از 9 نیوتن تا 23 نیوتن، 13 نیوتن نیمه عمر ده دقیقه و ایزوتوپ های باقی مانده نیمه عمر کمتر از هشت ثانیه دارند. [41] [42] با توجه به تفاوت نیمه عمر، 13 N مهمترین رادیو ایزوتوپ نیتروژن است، به اندازه کافی عمر طولانی دارد که در توموگرافی انتشار پوزیترون (PET) استفاده شود، اگرچه نیمه عمر آن هنوز کوتاه است و بنابراین باید در محل PET تولید شود، برای مثال در یک سیکلوترون از طریق بمباران پروتون 16 O که 13 N و یک ذره آلفا تولید می کند . [43]
رادیو ایزوتوپ 16 N رادیونوکلئید غالب در خنک کننده راکتورهای آب تحت فشار یا راکتورهای آب جوش در حین کار عادی است. این از 16 O (در آب) از طریق یک واکنش (n,p) تولید می شود که در آن اتم 16 O یک نوترون را می گیرد و یک پروتون را دفع می کند. نیمه عمر کوتاهی در حدود 7.1 ثانیه دارد، [42] اما واپاشی آن به 16 O، تابش گامای پرانرژی (5 تا 7 مگا ولت) تولید می کند. [42] [44] به همین دلیل، دسترسی به لولهکشی خنککننده اولیه در یک راکتور آب تحت فشار باید در طول عملیات قدرت راکتور محدود شود . [44] این نشانگر حساس و فوری نشتی از سیستم خنک کننده اولیه به چرخه بخار ثانویه است و ابزار اصلی تشخیص چنین نشت هایی است. [44]

نیتروژن اتمی، همچنین به عنوان نیتروژن فعال شناخته می شود، بسیار واکنش پذیر است، و یک سه رادیکال با سه الکترون جفت نشده است. اتم های نیتروژن آزاد به راحتی با اکثر عناصر واکنش می دهند و نیترید تشکیل می دهند، و حتی زمانی که دو اتم نیتروژن آزاد با هم برخورد می کنند تا یک مولکول N 2 برانگیخته تولید کنند، ممکن است در برخورد با مولکول های پایداری مانند دی اکسید کربن و آب انرژی زیادی آزاد کنند و باعث شکافت همولیتیک شوند. به رادیکالهایی مانند CO و O یا OH و H. نیتروژن اتمی با عبور دادن تخلیه الکتریکی از گاز نیتروژن با 0.1 تا 2 میلیمتر جیوه تهیه میشود که نیتروژن اتمی را همراه با انتشار زرد هلویی تولید میکند که به آرامی بهعنوان یک درخشش پس از آن برای چند دقیقه محو میشود. حتی پس از پایان ترخیص [28]
با توجه به واکنش پذیری زیاد نیتروژن اتمی، نیتروژن عنصری معمولاً به صورت N 2 مولکولی ، دی نیتروژن ظاهر می شود. این مولکول یک گاز دیامغناطیس بی رنگ، بی بو و بی مزه در شرایط استاندارد است: در دمای 210- درجه سانتی گراد ذوب می شود و در 196- درجه سانتی گراد می جوشد. [28] دی نیتروژن عمدتاً در دمای اتاق غیر فعال است، اما با این وجود با فلز لیتیوم و برخی کمپلکسهای فلزات واسطه واکنش نشان میدهد . این به دلیل پیوند آن است که در بین عناصر دو اتمی در شرایط استاندارد منحصر به فرد است زیرا دارای پیوند سه گانه N≡N است . پیوندهای سه گانه دارای طول پیوند کوتاه (در این مورد، 109.76 بعد از ظهر) و انرژی تفکیک بالا (در این مورد، 945.41 کیلوژول بر مول)، و بنابراین بسیار قوی هستند، که سطح پایین واکنش شیمیایی دی نیتروژن را توضیح می دهد. [28] [45]
سایر الیگومرها و پلیمرهای نیتروژن ممکن است امکان پذیر باشد. اگر بتوان آنها را سنتز کرد، ممکن است کاربردهای بالقوه ای به عنوان موادی با چگالی انرژی بسیار بالا داشته باشند که می توانند به عنوان پیشران یا مواد منفجره قوی استفاده شوند. [46] تحت فشارهای بسیار بالا (1.1 میلیون اتمسفر ) و دماهای بالا (2000 کلوین)، همانطور که در سلول سندان الماس تولید میشود ، نیتروژن به ساختار کریستالی گاوش مکعبی تک پیوندی پلیمریزه میشود. این ساختار شبیه به الماس است و هر دو دارای پیوندهای کووالانسی بسیار قوی هستند که در نتیجه نام مستعار آن "الماس نیتروژن" است. [47]

در فشار اتمسفر ، نیتروژن مولکولی در دمای 77 کلوین (195.79- درجه سانتیگراد ) متراکم می شود ( مایع می شود ) و در دمای 63 کلوین (210.01- درجه سانتیگراد) [48] منجمد می شود و به شکل آلوتروپیک کریستالی بسته شش ضلعی بتا تبدیل می شود . نیتروژن زیر 35.4 K (237.6- درجه سانتیگراد) شکل آلوتروپیک کریستالی مکعبی (به نام فاز آلفا) را به خود می گیرد. [49] نیتروژن مایع ، مایعی بی رنگ که از نظر ظاهری شبیه آب است، اما با 80.8 درصد چگالی (چگالی نیتروژن مایع در نقطه جوش آن 0.808 گرم در میلی لیتر است)، یک کرایوژن معمولی است . [50] نیتروژن جامد تغییرات کریستالی زیادی دارد. این پوشش سطح پویا قابل توجهی را در پلوتون [51] و قمرهای بیرونی منظومه شمسی مانند تریتون تشکیل می دهد . [52] حتی در دماهای پایین نیتروژن جامد، نسبتاً فرار است و می تواند برای تشکیل اتمسفر تعالی پیدا کند ، یا دوباره به یخ زدگی نیتروژن متراکم شود. بسیار ضعیف است و به شکل یخچال های طبیعی جریان دارد و روی تریتون آبفشان های گاز نیتروژن از ناحیه کلاهک یخی قطبی می آیند. [53]

اولین نمونه از یک کمپلکس دیتروژن که کشف شد [Ru(NH 3 ) 5 (N 2 )] 2+ بود (شکل سمت راست را ببینید)، و به زودی بسیاری از این مجتمع های دیگر کشف شدند. این کمپلکسها ، که در آنها یک مولکول نیتروژن حداقل یک جفت الکترون را به یک کاتیون فلزی مرکزی اهدا میکند، نشان میدهد که چگونه N 2 ممکن است به فلز (های) موجود در نیتروژناز و کاتالیزور فرآیند هابر متصل شود : این فرآیندها شامل فعالسازی دیتروژن هستند. در زیست شناسی و تولید کود بسیار مهم است. [54] [55]
دی نیتروژن قادر است به پنج روش مختلف با فلزات هماهنگ شود. راههای مشخصتر، M←N≡N ( η1 ) و M←N≡N→M ( μ ، bis- η1 ) هستند، که در آن جفتهای تنها روی اتمهای نیتروژن به اتمهای نیتروژن اهدا میشوند . کاتیون فلزی روشهای کمتر مشخصشده شامل اهدای دینیتروژن جفتهای الکترون از پیوند سهگانه، یا بهعنوان یک لیگاند پل زدنی به دو کاتیون فلزی ( μ , bis- η2 ) یا فقط به یک ( η2 ) است . روش پنجم و منحصر به فرد شامل هماهنگی سه گانه به عنوان یک لیگاند پل زدن، اهدای هر سه جفت الکترون از پیوند سه گانه ( μ3 -N2 ) است . تعداد کمی از کمپلکس ها دارای لیگاندهای N 2 متعدد و برخی از N 2 به روش های مختلف پیوند دارند. از آنجایی که N 2 با مونوکسید کربن (CO) و استیلن (C 2 H 2 ) ایزوالکترونیک است ، پیوند در کمپلکس های دی نیتروژن با ترکیبات کربونیل پیوند نزدیکی دارد ، اگرچه N 2 اهداکننده σ و π - پذیرنده ضعیف تری نسبت به CO است. مطالعات نظری نشان میدهد که اهدای σ عامل مهمتری برای تشکیل پیوند M-N نسبت به اهدای پشتی π است که عمدتاً فقط پیوند N-N را تضعیف میکند و اهدای نهایی ( η1 ) آسانتر از انجام میشود . جانبی ( η 2 ) اهداء. [28]
امروزه کمپلکسهای دینیتروژن تقریباً برای تمام فلزات واسطه شناخته شدهاند که صدها ترکیب را تشکیل میدهند. آنها معمولاً با سه روش تهیه می شوند: [28]
گاهی اوقات پیوند N≡N ممکن است مستقیماً در یک کمپلکس فلزی ایجاد شود، برای مثال با واکنش مستقیم آمونیاک هماهنگ (NH 3 ) با اسید نیتروژن (HNO 2 )، اما این به طور کلی قابل اجرا نیست. اکثر کمپلکس های دی نیتروژن دارای رنگ هایی در محدوده سفید-زرد-نارنجی-قرمز-قهوه ای هستند. چند استثنا شناخته شده است، مانند آبی [{Ti( η 5 -C 5 H 5 ) 2 } 2 - (N 2 )]. [28]
تقریباً به تمام عناصر جدول تناوبی به جز دو گاز نجیب اول ، هلیوم و نئون ، و برخی از عناصر بسیار کوتاه پس از بیسموت پیوند میخورد و تنوع بسیار زیادی از ترکیبات دوتایی با خواص و کاربردهای متفاوت ایجاد میکند. [28] بسیاری از ترکیبات دوتایی شناخته شده اند: به استثنای هیدریدهای نیتروژن، اکسیدها و فلوریدها، اینها معمولاً نیترید نامیده می شوند . بسیاری از فازهای استوکیومتری معمولاً برای اکثر عناصر وجود دارند (به عنوان مثال MnN، Mn6N5 ، Mn3N2 ، Mn2N ، Mn4N ، و MnxN برای 9.2 < x < 25.3 ). آنها ممکن است به عنوان "نمک مانند" (بیشتر یونی)، کووالانسی، "الماس مانند" و فلزی (یا بینابینی ) طبقه بندی شوند، اگرچه این طبقه بندی دارای محدودیت هایی است که عموماً از تداوم انواع پیوند به جای انواع مجزا و مجزا ناشی می شود. که دلالت دارد. آنها معمولاً با واکنش مستقیم یک فلز با نیتروژن یا آمونیاک (گاهی پس از گرم شدن) یا با تجزیه حرارتی آمیدهای فلزی تهیه می شوند: [56]
انواع مختلفی از این فرآیندها امکان پذیر است. یونی ترین این نیتریدها فلزات قلیایی و فلزات قلیایی خاکی هستند ، Li 3N (Na، K، Rb و Cs به دلایل فضایی نیتریدهای پایداری تشکیل نمی دهند) و M 3 N 2 (M = Be، Mg، Ca، Sr، Ba). اینها را می توان به طور رسمی به عنوان نمک های آنیون N 3- در نظر گرفت ، اگرچه جداسازی بار در واقع حتی برای این عناصر بسیار الکترومثبت کامل نیست. با این حال، آزیدهای فلز قلیایی NaN 3 و KN 3 ، دارای N خطی هستند.-
3آنیون ها، مانند Sr(N 3 ) 2 و Ba(N 3 ) 2 به خوبی شناخته شده اند . آزیدهای فلزات زیرگروه B (آنهایی که در گروه های 11 تا 16 قرار دارند) بسیار کمتر یونی هستند، ساختارهای پیچیده تری دارند و به راحتی در هنگام شوک منفجر می شوند. [56]
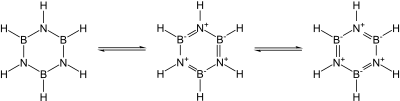
بسیاری از نیتریدهای دوتایی کووالانسی شناخته شده اند. به عنوان مثال می توان به سیانوژن ((CN) 2 )، پنتانیترید تری فسفر (P 3 N 5 )، دی گوگرد دینیترید (S 2 N 2 ) و تترا سولفور تترانیترید (S 4 N 4 ) اشاره کرد. نیترید سیلیکون اساسا کووالانسی (Si 3 N 4 ) و نیترید ژرمانیوم (Ge 3 N 4 ) نیز شناخته شده اند: به ویژه نیترید سیلیکون، اگر سختی کار با آن و تف جوشی آن نباشد، یک سرامیک امیدوارکننده می سازد. به ویژه، نیتریدهای گروه 13 ، که بیشتر آنها نیمه هادی های امیدوارکننده هستند ، با گرافیت، الماس و کاربید سیلیکون ایزوالکترونیک هستند و ساختارهای مشابهی دارند: پیوند آنها با نزول گروه از کووالانسی به تا حدی یونی به فلزی تغییر می کند. به ویژه، از آنجایی که واحد B-N نسبت به C-C ایزوالکترونیک است، و کربن اساساً از نظر اندازه بین بور و نیتروژن متوسط است، بسیاری از شیمی آلی در شیمی بور-نیتروژن، مانند بورازین (" بنزن معدنی " پژواک می یابد. ). با این وجود، این قیاس به دلیل سهولت حمله هسته دوست به بور به دلیل کمبود الکترون آن، که در یک حلقه کاملاً حاوی کربن امکان پذیر نیست، دقیق نیست. [56]
بزرگترین دسته نیتریدها نیتریدهای بینابینی با فرمول های MN، M 2 N و M 4 N هستند (اگرچه ترکیب متغیر کاملاً ممکن است)، که در آن اتم های کوچک نیتروژن در شکاف ها در یک شبکه فلزی مکعبی یا شش ضلعی قرار گرفته اند. . آنها مات، بسیار سخت و از نظر شیمیایی بی اثر هستند و فقط در دماهای بسیار بالا (معمولاً بالای 2500 درجه سانتیگراد) ذوب می شوند. آنها درخشش فلزی دارند و مانند فلزات الکتریسیته را هدایت می کنند. آنها بسیار آهسته هیدرولیز می شوند تا آمونیاک یا نیتروژن تولید کنند. [56]
آنیون نیترید (N3- ) قوی ترین دهنده π شناخته شده در بین لیگاندها است (دومین قوی ترین O2- است ) . کمپلکسهای نیتریدو عموماً با تجزیه حرارتی آزیدها یا با پروتون زدایی آمونیاک ساخته میشوند و معمولاً یک گروه انتهایی {≡N} 3- را شامل میشوند . آنیون آزید خطی ( N-
3ایزوالکترونیک بودن با اکسید نیتروژن ، دی اکسید کربن و سیانات ، کمپلکس های هماهنگی زیادی را تشکیل می دهد. کاتناسیون بیشتر نادر است، اگرچه N4-
4(ایزوالکترونیک با کربنات و نیترات ) شناخته شده است. [56]

از نظر صنعتی، آمونیاک (NH 3 ) مهمترین ترکیب نیتروژن است و در مقادیر بیشتری نسبت به هر ترکیب دیگری تهیه میشود، زیرا بهعنوان پیشساز غذا و کودها به نیازهای تغذیهای موجودات زمینی کمک زیادی میکند. این گاز قلیایی بی رنگ با بوی تند مشخص است. وجود پیوند هیدروژنی اثرات بسیار مهمی بر آمونیاک دارد و به آن نقطه ذوب بالا (78- درجه سانتیگراد) و جوش (33- درجه سانتیگراد) می دهد. به عنوان یک مایع، حلال بسیار خوبی با گرمای تبخیر بالا است (که آن را قادر می سازد در فلاسک های خلاء استفاده شود)، که همچنین دارای ویسکوزیته و هدایت الکتریکی کم و ثابت دی الکتریک بالا است و چگالی کمتری نسبت به آب دارد. با این حال، پیوند هیدروژنی در NH 3 به دلیل الکترونگاتیوی کمتر نیتروژن در مقایسه با اکسیژن و وجود تنها یک جفت تنها در NH 3 به جای دو در H 2 O ضعیف تر از پیوند H 2 O است. این یک باز ضعیف است. در محلول آبی ( p Kb 4.74 )؛ اسید مزدوج آن آمونیوم ، NH است+
4. همچنین می تواند به عنوان یک اسید بسیار ضعیف عمل کند و یک پروتون را برای تولید آنیون آمید، NH از دست بدهد-
2. بنابراین، مانند آب، برای تولید آمونیوم و آمید، تحت تجزیه خود قرار می گیرد. آمونیاک در هوا یا اکسیژن می سوزد، اگرچه به آسانی نمی تواند گاز نیتروژن تولید کند. در فلوئور با شعله زرد مایل به سبز می سوزد و تری فلوراید نیتروژن می دهد . واکنشها با سایر نافلزات بسیار پیچیده است و به ترکیبی از محصولات منجر میشود. آمونیاک در حرارت دادن با فلزات واکنش نشان می دهد و نیترید می دهد. [58]
بسیاری دیگر از نیتروژن هیدریدهای دوتایی شناخته شده اند، اما مهمترین آنها هیدرازین (N 2 H 4 ) و هیدروژن آزید (HN 3 ) هستند. اگرچه هیدروکسیل آمین (NH 2 OH) نیتروژن هیدرید نیست، از نظر خواص و ساختار مشابه آمونیاک و هیدرازین است. هیدرازین مایعی متعفن و بی رنگ است که بویی شبیه آمونیاک دارد. خواص فیزیکی آن بسیار شبیه به آب است (نقطه ذوب 2.0 درجه سانتی گراد، نقطه جوش 113.5 درجه سانتی گراد، چگالی 1.00 گرم بر سانتی متر مکعب ) . علیرغم اینکه یک ترکیب گرماگیر است، از نظر جنبشی پایدار است. این به سرعت و به طور کامل در هوا بسیار گرمازا می سوزد تا نیتروژن و بخار آب ایجاد کند. این یک عامل کاهنده بسیار مفید و همه کاره است و یک پایه ضعیف تر از آمونیاک است. [59] همچنین معمولاً به عنوان سوخت موشک استفاده می شود. [60]
هیدرازین به طور کلی از واکنش آمونیاک با هیپوکلریت سدیم قلیایی در حضور ژلاتین یا چسب ساخته می شود: [59]
(حملات هیدروکسید و آمونیاک ممکن است معکوس شوند، بنابراین به جای آن از NHCl میانی عبور می کنند ) . Cl) برای تولید کلرید آمونیوم و نیتروژن. [59]
هیدروژن آزید (HN 3 ) اولین بار در سال 1890 توسط اکسیداسیون هیدرازین آبی توسط اسید نیتروژن تولید شد. بسیار انفجاری است و حتی محلول های رقیق نیز می توانند خطرناک باشند. بوی نامطبوع و تحریک کننده ای دارد و یک سم بالقوه کشنده (اما نه تجمعی) است. ممکن است اسید مزدوج آنیون آزید در نظر گرفته شود و به طور مشابه با اسیدهای هیدروهالیک مشابه است . [59]

هر چهار تری هالید نیتروژن ساده شناخته شده اند. چند هالید مخلوط و هیدروهالید شناخته شده است، اما عمدتا ناپایدار هستند. نمونهها عبارتند از NClF 2 ، NCl 2 F، NBrF 2 ، NF 2 H، NFH 2 ، NCl 2 H و NClH 2 . [61]
تری فلوراید نیتروژن (NF 3 ، اولین بار در سال 1928 تهیه شد) یک گاز بی رنگ و بی بو است که از نظر ترمودینامیکی پایدار است و به راحتی از طریق الکترولیز فلورید آمونیوم مذاب حل شده در هیدروژن فلوراید بی آب تولید می شود . مانند تترا فلوراید کربن ، اصلاً واکنش پذیر نیست و در آب یا اسیدهای آبی رقیق یا قلیاها پایدار است. تنها زمانی که حرارت داده می شود به عنوان یک عامل فلوئور کننده عمل می کند و در تماس در دمای بالا با مس ، آرسنیک، آنتیموان و بیسموت واکنش نشان می دهد و تترافلوروهیدرازین (N 2 F 4 ) تولید می کند. کاتیون های NF+
4و N
2اف+
3همچنین شناخته شده اند (اخر از واکنش تترافلوروهیدرازین با گیرنده های قوی فلوراید مانند پنتافلوراید آرسنیک ) مانند ONF 3 که به دلیل فاصله کوتاه N-O که دلالت بر پیوند دوگانه جزئی و N-F بسیار قطبی و طولانی دارد، مورد توجه قرار گرفته است. اوراق قرضه تترافلوروهیدرازین، برخلاف خود هیدرازین، می تواند در دمای اتاق و بالاتر تجزیه شود و رادیکال NF 2 را ایجاد کند . فلوئور آزید (FN 3 ) بسیار انفجاری و از نظر حرارتی ناپایدار است. دی نیتروژن دی فلوراید (N 2 F 2 ) به عنوان ایزومرهای سیس و ترانس قابل تبدیل حرارتی وجود دارد و برای اولین بار به عنوان محصولی از تجزیه حرارتی FN 3 یافت شد . [61]
تری کلرید نیتروژن (NCl 3 ) مایعی متراکم، فرار و انفجاری است که خواص فیزیکی آن مشابه تتراکلرید کربن است ، اگرچه یک تفاوت این است که NCl3 به راحتی توسط آب هیدرولیز می شود در حالی که CCl4 اینطور نیست. این اولین بار در سال 1811 توسط پیر لوئیز دولونگ ساخته شد که سه انگشت و یک چشم خود را به دلیل تمایلات انفجاری خود از دست داد. به عنوان یک گاز رقیق، خطر کمتری دارد و بنابراین به صورت صنعتی برای سفید کردن و استریل کردن آرد استفاده می شود. تری برومید نیتروژن (NBr3 ) که برای اولین بار در سال 1975 تهیه شد، یک جامد فرار و قرمز تیره، حساس به دما و حتی در دمای 100- درجه سانتیگراد قابل انفجار است. تری یدید نیتروژن (NI 3 ) هنوز ناپایدارتر است و تنها در سال 1990 تهیه شد. ترکیب اضافی آن با آمونیاک، که قبلا شناخته شده بود، بسیار حساس به شوک است: می توان آن را با لمس یک پر، تغییر جریان هوا، یا حتی ذرات آلفا . [61] [62] به همین دلیل، گاهی اوقات مقادیر کمی تری یدید نیتروژن به عنوان نمایشی برای دانش آموزان شیمی دبیرستان یا به عنوان یک عمل "جادوی شیمیایی" سنتز می شود. [63] کلر آزید (ClN 3 ) و برم آزید (BrN 3 ) بسیار حساس و انفجاری هستند. [64] [65]
دو سری از اکسو هالیدهای نیتروژن شناخته شده اند: نیتروسیل هالیدها (XNO) و نیتریل هالیدها (XNO2 ) . اولین مورد گازهای بسیار واکنش پذیری است که می تواند با هالوژنه کردن مستقیم اکسید نیتروژن ساخته شود. نیتروزیل فلوراید (NOF) بی رنگ و یک عامل فلوئور کننده قوی است. نیتروزیل کلرید (NOCl) تقریباً به همان روش عمل می کند و اغلب به عنوان یک حلال یونیزه کننده استفاده می شود. نیتروزیل بروماید (NOBr) قرمز است. واکنشهای نیتریل هالیدها عمدتاً مشابه است: نیتریل فلوراید (FNO 2 ) و نیتریل کلرید (ClNO 2 ) نیز گازهای واکنش پذیر و عوامل هالوژنه قوی هستند. [61]

نیتروژن نه اکسید مولکولی را تشکیل می دهد که برخی از آنها اولین گازهایی بودند که شناسایی شدند: N 2 O ( اکسید نیتروژن )، NO ( اکسید نیتریک )، N 2 O 3 ( تری اکسید دی نیتروژن )، NO 2 ( دی اکسید نیتروژن )، N 2 O 4 ( دیتروژن تتروکسید )، N 2 O 5 ( پنتوکسید دی نیتروژن )، N 4 O ( نیتروسیلازید )، [66] و N(NO 2 ) 3 ( تری نیترامید ). [67] همه از نظر حرارتی نسبت به تجزیه به عناصر خود ناپایدار هستند. یکی دیگر از اکسیدهای احتمالی که هنوز سنتز نشده است، اگزاتترازول (N 4 O)، یک حلقه معطر است. [66]
اکسید نیتروژن (N 2 O) که بیشتر به عنوان گاز خنده شناخته می شود، از تجزیه حرارتی نیترات آمونیوم مذاب در دمای 250 درجه سانتی گراد ساخته می شود . این یک واکنش ردوکس است و بنابراین اکسید نیتریک و نیتروژن نیز به عنوان محصولات جانبی تولید می شوند. این بیشتر به عنوان یک عامل پیشران و هوادهی برای خامه فرم گرفته کنسرو شده استفاده می شود و قبلاً معمولاً به عنوان بی حس کننده استفاده می شد. علیرغم ظاهر، نمی توان آن را انیدرید اسید هیپونیتر (H 2 N 2 O 2 ) در نظر گرفت زیرا آن اسید از انحلال اکسید نیتروژن در آب تولید نمی شود. نسبتاً غیر فعال است (با هالوژن ها، فلزات قلیایی یا ازن در دمای اتاق واکنش نمی دهد، اگرچه واکنش پذیری با گرم شدن افزایش می یابد) و دارای ساختار نامتقارن N-N-O (N≡N + O - ↔ - N=N + است. =O): در دمای بالای 600 درجه سانتیگراد با شکستن پیوند ضعیف N-O تجزیه می شود. [66] اکسید نیتریک (NO) ساده ترین مولکول پایدار با تعداد فرد الکترون است. در پستانداران، از جمله انسان، این یک مولکول پیام رسانی سلولی مهم است که در بسیاری از فرآیندهای فیزیولوژیکی و پاتولوژیک نقش دارد. [68] از اکسیداسیون کاتالیزوری آمونیاک تشکیل می شود. این یک گاز پارامغناطیس بی رنگ است که از نظر ترمودینامیکی ناپایدار است، در دمای 1100-1200 درجه سانتیگراد به گاز نیتروژن و اکسیژن تجزیه می شود. پیوند آن شبیه پیوند نیتروژن است، اما یک الکترون اضافی به اوربیتال پادپیوند π * اضافه می شود و بنابراین ترتیب پیوند به تقریباً 2.5 کاهش می یابد. بنابراین دیمر شدن به O=N–N=O نامطلوب است به جز در زیر نقطه جوش (جایی که ایزومر سیس پایدارتر است) زیرا در واقع ترتیب پیوند کل را افزایش نمی دهد و به دلیل اینکه الکترون جفت نشده در سراسر مولکول NO جابجا می شود و به آن می پردازد. ثبات همچنین شواهدی برای دایمر قرمز نامتقارن O=N–O=N وجود دارد که اکسید نیتریک با مولکول های قطبی متراکم می شود. با اکسیژن واکنش داده و دی اکسید نیتروژن قهوه ای و با هالوژن ها نیتروزیل هالید می دهد. همچنین با ترکیبات فلزات واسطه واکنش نشان میدهد و کمپلکسهای نیتروزیل را به وجود میآورد که بیشتر آنها عمیقاً رنگی هستند. [66]
تری اکسید دی نیتروژن آبی (N 2 O 3 ) فقط به صورت جامد در دسترس است زیرا به سرعت در بالای نقطه ذوب خود تجزیه می شود و اکسید نیتریک ، دی اکسید نیتروژن (NO 2 ) و تتروکسید دی نیتروژن (N 2 O 4 ) می دهد. مطالعه دو ترکیب اخیر به دلیل تعادل بین آنها تا حدودی دشوار است، اگرچه گاهی اوقات تتروکسید دی نیتروژن می تواند با شکافت هترولیتیک به نیتروزونیوم و نیترات در محیطی با ثابت دی الکتریک بالا واکنش نشان دهد. دی اکسید نیتروژن یک گاز قهوه ای تند و خورنده است. هر دو ترکیب ممکن است به راحتی با تجزیه نیترات فلز خشک تهیه شوند. هر دو با آب واکنش می دهند و اسید نیتریک تشکیل می دهند . تتروکسید دی نیتروژن برای تهیه نیترات های فلزی بی آب و کمپلکس های نیتراتو بسیار مفید است و در اواخر دهه 1950 به اکسید کننده قابل ذخیره سازی انتخابی برای بسیاری از موشک ها در ایالات متحده و اتحاد جماهیر شوروی تبدیل شد. این به این دلیل است که یک پیشرانه هایپرگولیک در ترکیب با سوخت موشک مبتنی بر هیدرازین است و به راحتی قابل ذخیره است زیرا در دمای اتاق مایع است. [66]
پنتوکسید دیتروژن بسیار ناپایدار و بسیار واکنش پذیر از نظر حرارتی (N 2 O 5 ) انیدرید اسید نیتریک است و می توان از آن با آبگیری با پنتوکسید فسفر تهیه کرد . برای تهیه مواد منفجره مورد علاقه است. [69] این یک جامد کریستالی بی رنگ و رقیق است که به نور حساس است. در حالت جامد یونی با ساختار [NO 2 ] + [NO 3 ] - ; به صورت گاز و در محلول مولکولی O 2 N-O-NO 2 است . هیدراتاسیون به اسید نیتریک به آسانی انجام می شود، همانطور که واکنش مشابه با پراکسید هیدروژن که اسید پراکسونیتریک می دهد (HOONO 2 ) انجام می شود. این یک عامل اکسید کننده خشن است. پنتوکسید دیتروژن گازی به شرح زیر تجزیه می شود: [66]
بسیاری از اکسواسیدهای نیتروژن شناخته شده اند، اگرچه اکثر آنها به عنوان ترکیبات خالص ناپایدار هستند و تنها به عنوان محلول های آبی یا نمک شناخته می شوند. اسید هیپونیتروس (H 2 N 2 O 2 ) یک اسید دی پروتیک ضعیف با ساختار HON=NOH (p Ka1 6.9، p Ka2 11.6) است . محلولهای اسیدی کاملاً پایدار هستند، اما در بالای pH 4 تجزیه کاتالیزور پایه از طریق [HONNO] - به اکسید نیتروژن و آنیون هیدروکسید رخ میدهد. هیپونیتریت ها (شامل N
2O2-
2آنیون) نسبت به عوامل کاهنده پایدار هستند و معمولاً خود به عنوان عوامل کاهنده عمل می کنند. آنها یک مرحله میانی در اکسیداسیون آمونیاک به نیتریت هستند که در چرخه نیتروژن اتفاق می افتد . هیپونیتریت می تواند به عنوان یک لیگاند دودنت پل زدن یا کلات کننده عمل کند. [70]
اسید نیتروژن (HNO 2 ) به عنوان یک ترکیب خالص شناخته نمی شود، اما یک جزء رایج در تعادل گازی است و یک معرف آبی مهم است: محلول های آبی آن ممکن است از اسیدی کردن نیتریت های آبی خنک ( NO) ساخته شوند.-
2، خم شده) محلول ها، اگرچه در دمای اتاق نامتناسب با نیترات و اکسید نیتریک قابل توجه است. این یک اسید ضعیف با p K a 3.35 در دمای 18 درجه سانتیگراد است. آنها ممکن است با اکسیداسیون آنها به نیترات توسط پرمنگنات به صورت تیترومتری تجزیه و تحلیل شوند . آنها به راحتی توسط دی اکسید گوگرد به اکسید نیتروژن و اکسید نیتریک ، با قلع (II) به اسید هیپونیتر و با سولفید هیدروژن به آمونیاک تبدیل می شوند . نمک های هیدرازینیم N
2اچ+
5با اسید نیتروژن واکنش داده و آزید تولید می کند که بیشتر واکنش نشان می دهد و اکسید نیتروژن و نیتروژن می دهد. نیتریت سدیم در غلظتهای بالای 100 میلیگرم بر کیلوگرم سمی خفیف است، اما مقادیر کم آن اغلب برای درمان گوشت و به عنوان نگهدارنده برای جلوگیری از فساد باکتری استفاده میشود. همچنین برای سنتز هیدروکسیل آمین و دیازوتیز کردن آمین های آروماتیک اولیه به شرح زیر استفاده می شود : [70]
نیتریت همچنین یک لیگاند رایج است که می تواند به پنج روش هماهنگ شود. رایج ترین آنها نیترو (پیوند از نیتروژن) و نیتریتو (پیوند از اکسیژن) هستند. ایزومریسم نیترو-نیتریتو رایج است، جایی که شکل نیتریتو معمولاً پایداری کمتری دارد. [70]

اسید نیتریک (HNO 3 ) تا حد زیادی مهمترین و پایدارترین اکسواسید نیتروژن است. این یکی از سه اسید پر استفاده است (دو مورد دیگر اسید سولفوریک و اسید هیدروکلریک ) و اولین بار توسط کیمیاگران در قرن سیزدهم کشف شد. از اکسیداسیون کاتالیزوری آمونیاک به اکسید نیتریک ساخته می شود که به دی اکسید نیتروژن اکسید می شود و سپس در آب حل می شود تا اسید نیتریک غلیظ به دست آید. در ایالات متحده آمریکا سالانه بیش از هفت میلیون تن اسید نیتریک تولید می شود که بیشتر آن برای تولید نیترات برای کودها و مواد منفجره و سایر مصارف استفاده می شود. اسید نیتریک بی آب ممکن است با تقطیر اسید نیتریک غلیظ با پنتوکسید فسفر در فشار کم در دستگاه شیشه ای در تاریکی ساخته شود. آن را فقط می توان در حالت جامد ساخت، زیرا با ذوب شدن خود به خود به دی اکسید نیتروژن تجزیه می شود و اسید نیتریک مایع به میزان بیشتری نسبت به هر مایع کووالانسی دیگری تحت خودیونیزاسیون قرار می گیرد: [70]
دو هیدرات، HNO 3 · H 2 O و HNO 3 · 3H 2 O، شناخته شده اند که می توانند متبلور شوند. این یک اسید قوی است و محلول های غلیظ عامل اکسید کننده قوی هستند، اگرچه طلا ، پلاتین ، رودیوم و ایریدیوم در برابر حمله ایمن هستند. مخلوط 3:1 از اسید هیدروکلریک غلیظ و اسید نیتریک، به نام aqua regia ، هنوز قویتر است و طلا و پلاتین را با موفقیت حل میکند، زیرا کلر آزاد و کلرید نیتروزیل تشکیل میشوند و آنیونهای کلرید میتوانند کمپلکسهای قوی ایجاد کنند. در اسید سولفوریک غلیظ، اسید نیتریک پروتونه می شود تا نیترونیوم را تشکیل دهد که می تواند به عنوان یک الکتروفیل برای نیتراسیون معطر عمل کند: [70]
پایداری حرارتی نیترات ها (شامل NO مسطح مثلثی-
3آنیون) به اساسی بودن فلز بستگی دارد، و همچنین محصولات تجزیه (ترمولیز)، که می تواند بین نیتریت (مثلاً سدیم)، اکسید (پتاسیم و سرب )، یا حتی خود فلز ( نقره ) متفاوت باشد. بسته به ثبات نسبی آنها. نیترات همچنین یک لیگاند رایج با حالت های هماهنگی زیادی است. [70]
در نهایت، اگرچه اسید ارتونیتریک (H 3 NO 4 ) که مشابه اسید اورتوفسفریک است ، وجود ندارد، آنیون ارتونیترات چهار وجهی NO وجود ندارد.3-
4در نمک های سدیم و پتاسیم آن شناخته شده است: [70]
این نمک های کریستالی سفید به بخار آب و دی اکسید کربن موجود در هوا بسیار حساس هستند: [70]
علیرغم شیمی محدود آن، آنیون ارتونیترات از نظر ساختاری به دلیل شکل چهاروجهی منظم و طول پیوند N-O کوتاه آن جالب است، که دلالت بر ویژگی قطبی قابل توجهی برای پیوند دارد. [70]
نیتروژن یکی از مهمترین عناصر در شیمی آلی است . بسیاری از گروههای عاملی آلی شامل پیوند کربن-نیتروژن هستند ، مانند آمیدها (RCONR 2 )، آمینها (R3N ) ، ایمینها (RC(=NR)R)، ایمیدها (RCO) 2NR ، آزیدها (RN3 ) ، آزو. ترکیبات (RN 2 R)، سیانات ها (ROCN)، ایزوسیانات ها (RNCO) ، نیترات ها (RONO 2 )، نیتریل ها (RCN)، ایزونیتریل ها (RNC)، نیتریت ها (RONO)، ترکیبات نیترو (RNO 2 )، ترکیبات نیتروزو (RNO) ، اکسیم ها (RC(=NOH)R) و مشتقات پیریدین . پیوندهای C-N به شدت به سمت نیتروژن قطبی شده اند. در این ترکیبات، نیتروژن معمولاً سه ظرفیتی است (اگرچه می تواند در نمک های آمونیوم چهار ظرفیتی ، R4N + چهار ظرفیتی باشد )، با یک جفت تنها که می تواند با هماهنگ شدن با یک پروتون، بازی را به ترکیب بدهد. این ممکن است با عوامل دیگری جبران شود: به عنوان مثال، آمیدها اساسی نیستند زیرا جفت تنها به یک پیوند دوگانه تبدیل می شود (اگرچه ممکن است در pH بسیار پایین به عنوان پایه عمل کنند و در اکسیژن پروتونه شوند)، و پیرول اساسی نیست زیرا جفت تنها به عنوان بخشی از یک حلقه معطر جابجا می شود . [71] مقدار نیتروژن در یک ماده شیمیایی را می توان با روش کجلدال تعیین کرد . [72] به طور خاص، نیتروژن جزء ضروری اسیدهای نوکلئیک ، اسیدهای آمینه و در نتیجه پروتئین ها ، و مولکول حامل انرژی آدنوزین تری فسفات است و بنابراین برای تمام حیات روی زمین حیاتی است. [71]

نیتروژن رایج ترین عنصر خالص در زمین است که 78.1٪ از حجم جو را تشکیل می دهد [ 9] (75.5٪ از نظر جرم)، حدود 3.89 میلیون گیگا تن .3.89 × 10 18 کیلوگرم ). با وجود این، در پوسته زمین بسیار فراوان نیست و حدود 19 قسمت در میلیون از آن را تشکیل می دهد، همتراز با نیوبیم ، گالیوم و لیتیوم . (این نشان دهنده 300000 تا یک میلیون گیگاتن نیتروژن است، بسته به جرم پوسته. [73] ) تنها کانی های مهم نیتروژن نیتر ( نیترات پتاسیم ، نمک نمک) و نیتر سودا ( نیترات سدیم ، نمک شیلی) هستند. با این حال، از دهه 1920، زمانی که سنتز صنعتی آمونیاک و اسید نیتریک رایج شد، اینها منبع مهمی از نیترات نبودند. [74]
ترکیبات نیتروژن به طور مداوم بین جو و موجودات زنده تبادل می کنند. نیتروژن ابتدا باید فرآوری شود، یا " ثابت " شود و به شکل قابل استفاده در گیاه، معمولاً آمونیاک، تبدیل شود. برخی از تثبیت نیتروژن با برخورد صاعقه و تولید اکسیدهای نیتروژن انجام می شود، اما بیشتر آن توسط باکتری های دیازوتروف از طریق آنزیم هایی به نام نیتروژناز انجام می شود (اگرچه امروزه تثبیت نیتروژن صنعتی به آمونیاک نیز قابل توجه است). هنگامی که آمونیاک توسط گیاهان جذب می شود، از آن برای سنتز پروتئین استفاده می شود. سپس این گیاهان توسط حیواناتی که از ترکیبات نیتروژن برای سنتز پروتئین های خود و دفع مواد زائد نیتروژن دار استفاده می کنند هضم می شوند. در نهایت، این موجودات می میرند و تجزیه می شوند، تحت اکسیداسیون باکتریایی و محیطی و نیترات زدایی قرار می گیرند و دی نیتروژن آزاد را به اتمسفر باز می گرداند. تثبیت نیتروژن صنعتی توسط فرآیند هابر بیشتر به عنوان کود استفاده می شود، اگرچه زباله های حاوی نیتروژن اضافی، زمانی که شسته می شوند، منجر به اتروفیکاسیون آب شیرین و ایجاد مناطق مرده دریایی می شود ، زیرا رشد باکتری های نیتروژن باعث کاهش اکسیژن آب به حدی می شود که همه موجودات بالاتر می میرند علاوه بر این، اکسید نیتروژن که در حین نیترات زدایی تولید می شود، به لایه اوزون اتمسفر حمله می کند . [74]
بسیاری از ماهیان آب شور مقادیر زیادی اکسید تری متیل آمین تولید می کنند تا از اثرات اسمزی بالای محیط خود محافظت کنند . تبدیل این ترکیب به دی متیل آمین عامل بوی اولیه ماهیان آب شور است. [75] در حیوانات، اکسید نیتریک رادیکال آزاد (مشتق شده از یک اسید آمینه )، به عنوان یک مولکول تنظیم کننده مهم برای گردش خون عمل می کند. [76]
واکنش سریع نیتریک اکسید با آب در حیوانات منجر به تولید متابولیت نیتریت آن می شود . متابولیسم حیوانی نیتروژن در پروتئین ها به طور کلی منجر به دفع اوره می شود ، در حالی که متابولیسم حیوانی اسیدهای نوکلئیک منجر به دفع اوره و اسید اوریک می شود . بوی مشخصه پوسیدگی گوشت حیوانات به دلیل ایجاد آمین های با زنجیره بلند حاوی نیتروژن مانند پوترسین و کاداورین است که به ترتیب محصولات تجزیه اسیدهای آمینه اورنیتین و لیزین در پروتئین های در حال پوسیدگی هستند. [77]
گاز نیتروژن یک گاز صنعتی است که از تقطیر جزئی هوای مایع یا با ابزارهای مکانیکی با استفاده از هوای گازی ( غشاء اسمز معکوس تحت فشار یا جذب نوسان فشار ) تولید میشود. ژنراتورهای گاز نیتروژن که از غشاها یا جذب نوسان فشار (PSA) استفاده می کنند معمولاً نسبت به نیتروژن فله ای هزینه و انرژی کارآمدتری دارند. [78] نیتروژن تجاری اغلب محصول فرعی پردازش هوا برای غلظت صنعتی اکسیژن برای فولادسازی و سایر اهداف است. هنگامی که به صورت فشرده در سیلندر عرضه می شود، اغلب OFN (نیتروژن بدون اکسیژن) نامیده می شود. [79] نیتروژن با درجه تجاری در حال حاضر دارای حداکثر 20 ppm اکسیژن است، و گریدهای خالص شده ویژه حاوی حداکثر 2 ppm اکسیژن و 10 ppm آرگون نیز موجود است. [80]
در یک آزمایشگاه شیمی، از تیمار محلول آبی کلرید آمونیوم با نیتریت سدیم تهیه می شود . [81]
مقادیر کمی از ناخالصی های NO و HNO 3 نیز در این واکنش تشکیل می شود. ناخالصی ها را می توان با عبور گاز از اسید سولفوریک آبی حاوی دی کرومات پتاسیم حذف کرد . [81]
همچنین می توان آن را با تجزیه حرارتی دی کرومات آمونیوم به دست آورد . [82]
نیتروژن بسیار خالص را می توان با تجزیه حرارتی باریم آزید یا آزید سدیم تهیه کرد . [83]
کاربردهای ترکیبات نیتروژن به طور طبیعی به دلیل اندازه عظیم این کلاس بسیار متنوع است: از این رو، تنها کاربردهای خود نیتروژن خالص در اینجا در نظر گرفته می شود. دو سوم (2/3) نیتروژن تولید شده توسط صنعت به صورت گاز و یک سوم باقی مانده (1/3) به عنوان مایع فروخته می شود.
این گاز بیشتر به عنوان یک اتمسفر ایمن با واکنش پذیری کم استفاده می شود، هر جا که اکسیژن موجود در هوا باعث آتش سوزی، انفجار یا خطر اکسیداسیون شود. برخی از نمونه ها عبارتند از: [80]
نیتروژن معمولاً در هنگام آماده سازی نمونه در تجزیه و تحلیل شیمیایی استفاده می شود . برای تغلیظ و کاهش حجم نمونه های مایع استفاده می شود. هدایت یک جریان تحت فشار گاز نیتروژن عمود بر سطح مایع باعث می شود حلال تبخیر شود در حالی که املاح (ها) و حلال تبخیر نشده را پشت سر می گذارد. [89]
نیتروژن را می توان به عنوان جایگزین یا در ترکیب با دی اکسید کربن برای تحت فشار قرار دادن کیسه های برخی از آبجوها ، به ویژه آبجوهای غلیظ و دمنوش های بریتانیایی ، به دلیل حباب های کوچکتری که تولید می کند، استفاده کرد که باعث می شود ماءالشعیر روان تر و سرسبزتر شود . [90] یک کپسول نیتروژن حساس به فشار که معمولاً به عنوان " ویجت " شناخته می شود به آبجوهای دارای نیتروژن اجازه می دهد تا در قوطی ها و بطری ها بسته بندی شوند . [91] [92] مخازن نیتروژن همچنین جایگزین دی اکسید کربن به عنوان منبع اصلی انرژی برای تفنگ های پینت بال می شوند . نیتروژن باید در فشار بالاتری نسبت به CO 2 نگه داشته شود و مخازن N 2 سنگین تر و گران تر شود. [93]
برخی از تجهیزات ساختمانی از گاز نیتروژن تحت فشار برای کمک به سیستم هیدرولیک برای تامین نیروی اضافی برای دستگاه هایی مانند چکش هیدرولیک استفاده می کنند . گاز نیتروژن که از تجزیه سدیم آزید ایجاد می شود ، برای باد کردن کیسه های هوا استفاده می شود . [94]
از آنجایی که نیتروژن به خودی خود یک گاز خفه کننده است، برخی از مراجع قضایی خفگی با استنشاق نیتروژن خالص را به عنوان وسیله ای برای مجازات اعدام (به عنوان جایگزینی برای تزریق کشنده ) در نظر گرفته اند. [95] [96] [97] در ژانویه 2024، کنت یوجین اسمیت اولین فردی بود که توسط خفگی نیتروژن اعدام شد. [98]
نیتروژن مایع یک مایع برودتی است که شبیه آب است . هنگامی که در ظروف مناسب مانند فلاسک دیوار عایق بندی شود ، می توان آن را با سرعت کم تبخیر حمل و نگهداری کرد . [99]

مانند یخ خشک ، کاربرد اصلی نیتروژن مایع برای خنک کردن تا دمای پایین است. در انجماد مواد بیولوژیکی مانند خون و سلول های تولید مثلی ( اسپرم و تخمک ) استفاده می شود . در کرایوتراپی برای از بین بردن کیست ها و زگیل های روی پوست با انجماد آنها استفاده می شود . [100] در تلههای سرد آزمایشگاهی و در پمپهای سرمایی برای به دست آوردن فشار کمتر در سیستمهای پمپ خلاء استفاده میشود . برای خنک کردن وسایل الکترونیکی حساس به حرارت مانند آشکارسازهای مادون قرمز و آشکارسازهای اشعه ایکس استفاده می شود . کاربردهای دیگر عبارتند از: مواد یخزنی و ماشینکاری که در دمای اتاق نرم یا لاستیکی هستند، اجزای مهندسی را جمعآوری میکنند و به طور کلی برای رسیدن به دمای بسیار پایین در صورت لزوم. به دلیل هزینه کم، نیتروژن مایع اغلب برای خنکسازی استفاده میشود، حتی زمانی که چنین دماهای پایینی کاملاً ضروری نیستند، مانند سرد کردن مواد غذایی، دامها با نام تجاری انجماد ، لولههای انجماد برای توقف جریان در صورت عدم وجود دریچهها، و تحکیم خاک ناپایدار توسط یخ زدن هر زمان که حفاری در زیر انجام می شود. [80]
اگرچه نیتروژن غیر سمی است، اما هنگامی که در یک فضای بسته آزاد می شود می تواند اکسیژن را جابجا کند و بنابراین خطر خفگی را ایجاد می کند . این ممکن است با علائم هشدار دهنده کمی اتفاق بیفتد، زیرا بدن کاروتید انسان یک سیستم نسبتا ضعیف و آهسته حس کننده اکسیژن کم (هیپوکسی) است. [101] یک مثال کمی قبل از پرتاب اولین ماموریت شاتل فضایی در 19 مارس 1981 رخ داد، زمانی که دو تکنسین پس از ورود به فضایی واقع در سکوی پرتابگر متحرک شاتل فضایی که با نیتروژن خالص تحت فشار بود، بر اثر خفگی جان خود را از دست دادند. احتیاط در برابر آتش [102]
هنگامی که نیتروژن با فشارهای جزئی بالا (بیش از حدود 4 بار، در اعماق کمتر از حدود 30 متر در غواصی با آن مواجه می شود ) استنشاق می شود، یک عامل بی حس کننده است که باعث نارکوزیس نیتروژن می شود ، یک حالت موقتی از اختلال روانی شبیه مسمومیت با اکسید نیتروژن . [103] [104]
نیتروژن در خون و چربی های بدن حل می شود. رفع فشار سریع (مانند زمانی که غواصان خیلی سریع صعود می کنند یا فضانوردان خیلی سریع از فشار کابین به فشار لباس فضانوردی خارج می شوند) می تواند منجر به یک وضعیت بالقوه کشنده به نام بیماری رفع فشار (که قبلاً به عنوان بیماری کیسون یا خمیدگی شناخته می شد ) شود، زمانی که حباب های نیتروژن در جریان خون تشکیل می شود. اعصاب، مفاصل و سایر نواحی حساس یا حیاتی. [105] [106] حباب های دیگر گازهای "بی اثر" (گازهایی غیر از دی اکسید کربن و اکسیژن) همین اثرات را ایجاد می کنند، بنابراین جایگزینی نیتروژن در گازهای تنفسی ممکن است از نارکوز نیتروژن جلوگیری کند، اما از بیماری فشارزدایی جلوگیری نمی کند. [107]
به عنوان یک مایع برودتی ، نیتروژن مایع می تواند با ایجاد سوختگی سرد در هنگام تماس خطرناک باشد ، اگرچه اثر Leidenfrost از قرار گرفتن در معرض بسیار کوتاه (حدود یک ثانیه) محافظت می کند. [108] مصرف نیتروژن مایع می تواند باعث آسیب شدید داخلی شود. به عنوان مثال، در سال 2012، یک زن جوان در انگلیس پس از خوردن یک کوکتل ساخته شده با نیتروژن مایع، مجبور شد معده خود را خارج کند. [109]
از آنجایی که نسبت انبساط مایع به گاز نیتروژن 1:694 در 20 درجه سانتیگراد است، اگر نیتروژن مایع به سرعت در یک فضای بسته تبخیر شود، نیروی عظیمی می تواند ایجاد شود. در یک حادثه در 12 ژانویه 2006، در دانشگاه A&M تگزاس ، دستگاههای کاهش فشار مخزن نیتروژن مایع دچار مشکل شد و بعداً مهر و موم شدند. در نتیجه افزایش فشار بعدی، مخزن به طرز فاجعهباری از کار افتاد. نیروی انفجار برای به حرکت درآوردن مخزن از سقف بلافاصله در بالای آن، شکستن یک تیر بتن مسلح بلافاصله در زیر آن و وزش دیوارهای آزمایشگاه 0.1 تا 0.2 متر از پایه آن کافی بود. [110]
نیتروژن مایع به آسانی تبخیر می شود تا نیتروژن گازی را تشکیل دهد و از این رو اقدامات احتیاطی مرتبط با نیتروژن گازی در مورد نیتروژن مایع نیز اعمال می شود. [111] [112] [113] به عنوان مثال، سنسورهای اکسیژن گاهی اوقات به عنوان یک اقدام احتیاطی در هنگام کار با نیتروژن مایع برای هشدار به کارگران از نشت گاز در یک فضای محدود استفاده می شود. [114]
کشتی های حاوی نیتروژن مایع می توانند اکسیژن هوا را متراکم کنند. مایع موجود در چنین ظرفی با تبخیر نیتروژن به طور فزاینده ای از نظر اکسیژن (نقطه جوش 183- درجه سانتیگراد، بالاتر از نیتروژن) غنی می شود و می تواند باعث اکسیداسیون شدید مواد آلی شود. [115]
مانیتورهای کمبود اکسیژن برای اندازه گیری سطوح اکسیژن در فضاهای محدود و هر مکانی که گاز یا مایع نیتروژن ذخیره یا استفاده می شود استفاده می شود. در صورت نشت نیتروژن و کاهش اکسیژن به سطح هشدار از پیش تنظیم شده، می توان یک مانیتور کمبود اکسیژن را طوری برنامه ریزی کرد که آلارم های صوتی و تصویری را تنظیم کند و از این طریق هشدار خطر احتمالی قریب الوقوع را ارائه دهد. معمولاً محدوده اکسیژن برای هشدار به پرسنل زمانی است که سطح اکسیژن به زیر 19.5٪ برسد. OSHA مشخص می کند که یک جو خطرناک ممکن است شامل جوی باشد که غلظت اکسیژن آن زیر 19.5٪ یا بالاتر از 23.5٪ باشد. [116] مانیتورهای کمبود اکسیژن را می توان ثابت کرد، به دیوار نصب کرد و به منبع برق ساختمان متصل کرد یا به سادگی به پریز برق یا یک مانیتور دستی یا پوشیدنی قابل حمل وصل کرد.
{{cite journal}}: CS1 maint: URL نامناسب ( پیوند ){{cite journal}}: CS1 maint: URL نامناسب ( پیوند ){{cite journal}}: CS1 maint: URL نامناسب ( پیوند ){{cite journal}}: CS1 maint: URL نامناسب ( پیوند )