Zingibain ، zingipain یا پروتئاز زنجبیل ( EC 3.4.22.67) یک آنزیم سیستئین پروتئاز است که در ریزوم های زنجبیل ( Zingiber officinale ) یافت می شود . [1] [2] [3] این برش ترجیحی پپتیدها را با باقیمانده پرولین در موقعیت P2 کاتالیز می کند . دو شکل مجزا دارد ، پروتئاز زنجبیل I (GP-I) و پروتئاز زنجبیل II (GP-II). [4]
به عنوان عضوی از خانواده پروتئازهای شبه پاپائین سیستئین پروتئازها، zingibain دارای چندین شباهت ساختاری و عملکردی با آنزیم های به خوبی مطالعه شده مانند پاپائین ، بروملین و اکتینیدین است . این پپتیدازها حاوی یک باقیمانده سیستئین فعال در مراکز خود هستند که برش هیدرولیتیک پیوندهای پپتیدی را کاتالیز می کند. Zingibain به دلیل فعالیت آن به عنوان یک پروتئیناز و یک کلاژناز مورد توجه قرار گرفته است . [1]
اولین بار در سال 1973 توسط Ichikawa و همکارانش جداسازی، خالص سازی و گزارش شد. در دانشگاه زنان ژاپن [5] اخیراً، zingibain به عنوان دو ایزوآنزیم GP-I و GP-II وجود دارد که با کروماتوگرافی، با وزن مولکولی تقریباً 22500 Da، جدا شده اند. [5]
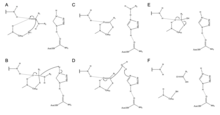
Zingibain از یک سه گانه کاتالیزوری از باقیمانده های Cys، His و Asn در محل فعال خود برای جدا کردن پیوندهای پپتیدی به صورت هیدرولیتیکی استفاده می کند. وجود Asn175 حلقه ایمیدازول His را تثبیت میکند و اطمینان میدهد که در موقعیت بهینه برای کاتالیز هیدرولیز قرار میگیرد.
مکانیسم با انتقال پروتون از Cys25 به His159 آغاز می شود. [6] سپس آنیون سولفید به کربن آلفای اسید آمینه حمله می کند و گروه آمین را که به His159 متصل می شود، جابجا می کند . [6] سپس کربن آلفا روی اسید آمینه تثبیت شده توسط یک مولکول آب مورد حمله قرار می گیرد که سولفید Cys25 را جابجا می کند تا اسید آمینه را به یک اسید کربوکسیلیک تبدیل کند که از محل فعال آنزیم آزاد می شود. [6]
معرفی تجربی دی تیوتریتول ، یک محافظ شناخته شده گروه تیول ، فعالیت پروتئولیتیک را بهبود می بخشد و تأیید بیشتر اهمیت باقی مانده سیستئین مرکزی را برای فعالیت آنزیمی فراهم می کند. [7]
Zingibain حداکثر نرخ گردش را در 60 درجه سانتیگراد نشان می دهد و به سرعت در دمای 70 درجه سانتیگراد دناتوره می شود. [8] پروتئولیز تا حد زیادی در طول پخت و پز با زنجبیل بدون مانع است. محدوده دمایی مطلوب پاپائین و فیسین نسبت به زینگی باین افزایش می یابد، در حالی که بروملین در محدوده کمی پایین تر عمل می کند. [7]
حداکثر فعالیت پروتئولیتیک zingibain در pH 6.0 رخ می دهد، اگرچه آنزیم هنوز در محدوده pH از 4.5 تا 6.0 فعال است (PH بهینه برای مارینادهای گوشت ). [7]
GP-II، اسیدی تر از دو ایزوآنزیم، pI برابر 4.82 را نشان می دهد و GP-I مقادیر pI را در 5.05 یا 5.16 نشان می دهد. [1] این مقادیر متعدد pI از این نظریه پشتیبانی می کند که GP-I ممکن است مخلوطی از دو پروتئین باشد.
Zingibain اولین بار در سال 2000 توسط محققان دانشگاه بوستون با کریستالوگرافی اشعه ایکس خالص و مشخص شد . [1]
این آنزیم دارای 221 اسید آمینه طولانی است و با 2 زنجیره الیگوساکارید متصل به N در Asn96 و Asn154 گلیکوزیله شده است. [3] زنجیره پلی پپتیدی zingibain به دو حوزه قطبی با اندازه تقریبا مساوی، که توسط یک شکاف خنثی مرکزی تقسیم میشود، تا میشود. [3] دامنه اول شامل مارپیچ های آلفا است و دومین دامنه دارای صفحات بتای ضد موازی است . [3] این جداسازی نواحی قطبی و غیرقطبی، تعاملات پروتئین-پروتئین بین آنزیم و طیف وسیعی از سوبستراها را تسهیل میکند. [3]
محل فعال zingibain، واقع در شکاف مرکزی، 5.5 Å عمق و 9.5 Å طول دارد. [3] سایت فعال شامل سه گانه کاتالیزوری Cys25، His159، و Asn175 است که هر دو با همکاری یکدیگر کاتالیز اسید/باز را امکان پذیر می کنند.
Zingibain ویژگی اتصال به سوبستراهای پپتیدی را با پرولین در موقعیت P2 نشان می دهد. [1] زیر سایت S2 zingibain حاوی زنجیره اسید آمینه Trp67-Met68-Asn69-Thr133-Ala157 است، که باعث می شود محل برای قرار دادن بقایای سوبسترای معطر آبگریز بزرگتر مورد علاقه دیگر آنزیم های خانواده پاپائین بسیار فشرده باشد. [1] پرولین، با این حال، توسط برهمکنش های غیرکووالانسی متعدد با این منطقه تثبیت می شود.
ساختار آنزیم توسط پیوندهای هیدروژنی و همچنین پیوندهای عرضی سولفیدی بین سه جفت باقیمانده سیستئین (Cys22-Cys63، Cys56-Cys95 و Cys153-Cys200) تثبیت می شود، مشابه بسیاری از پاپین های دیگر. [1]
در حالی که آنزیم به صورت مونومر در محلول وجود دارد، زینگیبائین متبلور تترامرها یا دایمرهای دایمرها را تشکیل میدهد که توسط زنجیرههای گلیکوزیلاسیون در هر زیر واحد به هم متصل میشوند. Zingibain زنجیرههای الیگوساکاریدی متصل به N از نوع پیچیده را در دو باقیمانده نشان میدهد. [1] زنجیره ها بین 5-13 واحد گلیکوزیل طول دارند و از N-استیل گلوکزامین ، فوکوز ، مانوز و زایلوز تشکیل شده اند . توالی های قند زینگی باین تقریباً مشابه الیگوساکاریدهایی است که در لکتین های دانه درختان بتکده ژاپنی ، لاکاز a از سلول های چنار و S-گلیکوپروتئین های Brassica campestris مشاهده می شود . [1]
در ریزوم های زنجبیل، پروتئاز زنجبیل در نقش های عملکردی متعددی برای نگهداری و نگهداری سلول های گیاهی شرکت می کند .
Zingibain، مانند بسیاری از سیستئین پروتئازها، به عنوان یک پروپروتئین 40-50 کیلو دالتون در پلی زوم های سیتوپلاسمی متصل به غشای سلولی سنتز می شود . [9] در داخل شبکه آندوپلاسمی ، این زنجیرههای دراز با یک سیگنال حفظ KDEL ER برچسبگذاری شده و در وزیکولهای بزرگ KDEL قرار میگیرند که از ER به واکوئلهای ذخیرهسازی پروتئین در دیوارههای سلولی حرکت میکنند . [9]
Zingibain احتمالاً در ذخیره پروتئین (در دانه ها یا بافت گیاهی ) شرکت می کند، اما عمدتاً پروتئین های ذخیره را تخریب و بسیج می کند. همچنین میتواند به استرسهای غیرزیستی و زیستی ، مانند شوک گرمایی ، دمای سرد و کمآبی پاسخ دهد تا پروتئینهای تاخورده یا دناتوره شده ناشی از آن را از بین ببرد . [9]
مانند پاپائین از پاپایا و بروملین از آناناس به عنوان نرم کننده گوشت استفاده می شود . [10] [11]
نشان داده شده است که وقتی به گوشت پخت و پز، معمولاً در زنجبیل خام یا خشک، اضافه می شود، لطافت گوشت را افزایش می دهد. [8] [12] نرم شدن گوشت به دلیل پروتئولیز سریع zingibain از پروتئین های اصلی ماهیچه در گوشت، به ویژه اکتومیوزین و کلاژن نوع I ، که در مفاصل عضلانی یافت می شود، رخ می دهد . [8]
در حالی که سایر آنزیمهای پاپائین، از جمله پاپائین، فیسین و بروملین، بیشتر برای نرم کردن گوشت استفاده میشوند، زینگیبائین فعالیت پروتئولیتیک مشابه یا افزایشی نشان میدهد. [11] در واقع، zingibain تنها پروتئاز گیاهی فهرست شده با فعالیت کلاژنولیتیک است. Zingibain ممکن است به دلیل بافت حاصل از گوشت تولید شده، نرم کننده گوشت ترجیحی نسبت به پاپائین باشد. در حالی که پاپائین می تواند اکتومیوزین را هیدرولیز کند، سایر پروتئین های اصلی بافت را نیز تجزیه می کند که منجر به بافت گوشتی نرم می شود. [11] ویژگی اتصال zingibain هیدرولیز غالب اکتومیوزین و کلاژن نوع I را تضمین می کند.
زینگی باین همچنین برای طعم دادن به سوسیس و محصولات پخته استفاده می شود . [8]
در طول 100 سال گذشته، پروتئاز زنجبیل به طور سنتی برای بستن شیر برای ایجاد کشک شیر زنجبیل ، یک غذای کانتونی ژل مانند که از شیر داغ و آب زنجبیل تهیه میشود، استفاده شده است . توانایی لخته شدن شیر و ویژگی پروتئاز زنجبیل به پروتئولیز ک-کازئین، این آنزیم را به یک جایگزین بالقوه مایه مایه سبزی برای تولید پنیر تبدیل می کند .
انعقاد شیر به طور سنتی توسط آنزیم های انعقادی استخراج شده از منابعی مانند مایه پنیر انجام می شود. در مایه پنیر، سه ایزوآنزیم کیموسین ک-کازئین، بخش پروتئینی اصلی شیر را بین Phe105 و Met106 هیدرولیز می کنند . نواحی فرعی آبدوست κ-کازئین جدا میشوند و دانههای عمدتاً آبگریز را پشت سر میگذارند. بنابراین، آنزیمها میسلهای κ-کازئین را بیثبات میکنند و تجمع باقیماندههای پروتئین آبگریز را تشویق میکنند و باعث میشوند که شیر منجمد شود.
اشکالات صنعتی عمده مایه پنیر شامل عرضه محدود و هزینه بالای آن، غیرقابل دسترس بودن آن برای گیاهخواران و اعضای عمل کننده گروه های مذهبی خاص ، و ممنوعیت اخیر ملی اروپا در استفاده از مایه پنیر گوساله نوترکیب است . [13] پروتئازهای قارچی تا حد زیادی به عنوان جایگزین مایه پنیر نامناسب هستند و نشان داده شده است که آنزیم های بسیاری از عصاره های گیاهی بازده پایین، بافت ضعیف و طعم تلخ پنیر تولید می کنند. [13]
با این حال، پروتئاز خام زنجبیل استخراج شده از عصاره زنجبیل ناپایدار است، با نیمه عمر حدود 2 روز در دمای 5 درجه سانتی گراد، که آن را برای کاربردهای تجاری مشکل ساز می کند. [14] در حالی که نیمه عمر آنزیم مانع از کارآیی آن در طول پخت و پز نمی شود، این پایداری ذخیره سازی کم نیاز به بهبود برای تجاری سازی دارد.
تلاشهای تجاری برای تثبیت آنزیم برای تولید در مقیاس بزرگ، روشهای بالقوه را برای غیرفعال کردن گروه سولفیدریل آزاد در محل فعال آنزیم بررسی کردهاند. احتمالات مکانیکی شامل اکسید کردن سولفیدریل، تبادل آن با پل های دی سولفیدی ، تشکیل ترکیب های افزایشی کینون -تیول، یا اتصال سولفیدریل به یون فلز سنگین است . [14] 0.2% آسکوربات سدیم برای تثبیت زینگی باین تا 14 روز در دمای 5 درجه سانتیگراد یافت شد، در حالی که غلظت های قابل مقایسه EDTA و CaCl2 کمترین تأثیر را بر پایداری داشتند. [14]
مشاهده شده است که Zingibain خود را از طریق اتولیز غیرفعال می کند، که می توان با واکنش گروه سولفیدریل فعال با سیستین یا PCMB از آن جلوگیری کرد . [14]
پودرهای استون یک روش تجاری مناسب برای تثبیت زینگی باین است. پس از حذف پلی فنل های گیاهی آبگریز از زنجبیل خام، پودر استون در دماهای پایین وارد می شود تا خمیر ریشه را از بین ببرد. [14] این آنزیم به دلیل کاهش فعالیت آب، غلظت کمتر رنگدانههای گیاهی و ساختارهای سه بعدی سفتتر در دماهای پایینتر تثبیت میشود. [14]