

در شیمی ، حلالیت توانایی یک ماده ، املاح ، برای تشکیل محلول با ماده دیگر، حلال است . نامحلول بودن خاصیت مخالف است، یعنی ناتوانی املاح در تشکیل چنین محلولی.
میزان حلالیت یک ماده در یک حلال خاص به طور کلی به عنوان غلظت املاح در یک محلول اشباع اندازه گیری می شود، محلولی که در آن هیچ املاحی دیگری نمی تواند حل شود. [1] در این مرحله، گفته میشود که دو ماده در تعادل حلالیت هستند . برای برخی از املاح و حلال ها، ممکن است چنین محدودیتی وجود نداشته باشد، در این صورت گفته می شود که این دو ماده " در همه نسبت ها قابل اختلاط " هستند (یا فقط "قابل اختلاط"). [2]
املاح می تواند جامد ، مایع یا گاز باشد ، در حالی که حلال معمولا جامد یا مایع است. هر دو ممکن است مواد خالص باشند یا خود محلول باشند. گازها همیشه در همه نسبتها قابل اختلاط هستند، به جز در موقعیتهای بسیار شدید، [3] و یک جامد یا مایع را میتوان در یک گاز تنها با ورود به حالت گازی ابتدا حل کرد.
حلالیت عمدتاً به ترکیب املاح و حلال (شامل pH آنها و حضور سایر مواد محلول) و همچنین به دما و فشار بستگی دارد. این وابستگی را اغلب میتوان بر حسب برهمکنشهای بین ذرات ( اتمها ، مولکولها یا یونهای ) دو ماده و مفاهیم ترمودینامیکی مانند آنتالپی و آنتروپی توضیح داد .
تحت شرایط خاص، غلظت املاح می تواند از حد حلالیت معمول آن فراتر رود. نتیجه یک محلول فوق اشباع است که فراپایدار است و در صورت ظاهر شدن محل هسته زایی مناسب، به سرعت املاح اضافی را حذف می کند . [4]
مفهوم حلالیت زمانی که یک واکنش شیمیایی برگشت ناپذیر بین دو ماده وجود دارد، مانند واکنش هیدروکسید کلسیم با اسید هیدروکلریک ، کاربرد ندارد . حتی اگر به طور غیررسمی بتوان گفت که یکی دیگری را "منحل کرد". حلالیت نیز با سرعت محلول یکسان نیست ، یعنی سرعت حل شدن یک محلول جامد در یک حلال مایع است. این خاصیت به بسیاری از متغیرهای دیگر مانند شکل فیزیکی دو ماده و نحوه و شدت اختلاط بستگی دارد.
مفهوم و معیار انحلال پذیری در بسیاری از علوم علاوه بر شیمی از جمله زمین شناسی ، زیست شناسی ، فیزیک و اقیانوس شناسی و همچنین در مهندسی ، پزشکی ، کشاورزی و حتی در فعالیت های غیر فنی مانند نقاشی ، نظافت ، آشپزی و ... بسیار مهم است. و دم کردن . بیشتر واکنش های شیمیایی مورد علاقه علمی، صنعتی یا عملی تنها پس از حل شدن معرف ها در یک حلال مناسب اتفاق می افتد. آب تا حد زیادی رایج ترین حلال است.
اصطلاح "محلول" گاهی اوقات برای موادی استفاده می شود که می توانند سوسپانسیون های کلوئیدی ذرات جامد بسیار ریز را در یک مایع تشکیل دهند. [5] حلالیت کمی چنین موادی معمولاً به خوبی تعریف نشده است.
حلالیت یک املاح خاص در یک حلال خاص به طور کلی به عنوان غلظت یک محلول اشباع از این دو بیان می شود. [1] می توان از هر یک از چندین روش برای بیان غلظت محلول ها استفاده کرد، مانند جرم ، حجم ، یا مقدار بر حسب مول املاح برای جرم، حجم یا مقدار مول خاصی از حلال یا محلول.
به طور خاص، کتاب های راهنمای شیمی اغلب حلالیت را به صورت گرم املاح در 100 میلی لیتر حلال (گرم/(100 میلی لیتر)، اغلب به صورت گرم در 100 میلی لیتر) یا به صورت گرم املاح در هر دسی لیتر حلال (گرم در دسی لیتر) بیان می کنند. یا کمتر به صورت گرم املاح در لیتر حلال (g/L). مقدار حلال را می توان به صورت جرمی، به صورت گرم املاح در هر 100 گرم حلال (g/(100 g)، اغلب به صورت g/100 g نوشته می شود)، یا به صورت گرم املاح در هر کیلوگرم حلال (g/kg) بیان کرد. ). ممکن است عدد در این مورد به صورت درصد بیان شود و از علامت اختصاری "w/w" برای نشان دادن "وزن به ازای هر وزن" استفاده شود. [6] (مقادیر g/L و g/kg برای آب مشابه است، اما ممکن است برای حلالهای دیگر اینطور نباشد.)
روش دیگر، حلالیت یک املاح را می توان به جای جرم در مول بیان کرد. به عنوان مثال، اگر مقدار حلال به کیلوگرم داده شود ، مقدار آن مولالیته محلول (mol/kg) است.
حلالیت یک ماده در یک مایع نیز ممکن است به عنوان مقدار املاح در هر مقدار محلول بیان شود ، نه حلال. به عنوان مثال، به دنبال روش معمول در تیتراسیون ، ممکن است به صورت مول املاح در لیتر محلول (mol/L)، مولاریته دومی بیان شود.
در زمینه های تخصصی تر، حلالیت ممکن است توسط کسر مولی (مول املاح در مول کل املاح به اضافه حلال) یا با کسر جرمی در حالت تعادل (جرم املاح در هر جرم املاح به اضافه حلال) داده شود. هر دو اعداد بدون بعد بین 0 و 1 هستند که ممکن است به صورت درصد (%) بیان شوند .
برای محلولهای مایعات یا گازها در مایعات، مقدار هر دو ماده ممکن است به جای جرم یا مول حجم داده شود. مانند لیتر املاح در لیتر حلال یا لیتر املاح در لیتر محلول. مقدار ممکن است به صورت درصد داده شود، و مخفف "v/v" برای "ولوم در هر جلد" ممکن است برای نشان دادن این انتخاب استفاده شود.
تبدیل بین این روشهای مختلف اندازهگیری حلالیت ممکن است بیاهمیت نباشد، زیرا ممکن است به دانستن چگالی محلول نیاز داشته باشد - که اغلب اندازهگیری نمیشود و نمیتوان آن را پیشبینی کرد. در حالی که جرم کل با انحلال حفظ می شود، حجم نهایی ممکن است با حجم حلال و مجموع دو حجم متفاوت باشد. [7]
علاوه بر این، بسیاری از جامدات (مانند اسیدها و نمک ها ) در صورت حل شدن به روش های غیر ضروری تجزیه می شوند. برعکس، حلال ممکن است کمپلکس های هماهنگی با مولکول ها یا یون های املاح تشکیل دهد. در این موارد، مجموع مولهای مولکولهای املاح و حلال واقعاً مجموع مولهای محلول ذرات مستقل نیست. برای کنار گذاشتن این مسئله، حلالیت در هر مول محلول معمولاً محاسبه و نقل می شود که گویی املاح تفکیک یا تشکیل کمپلکس نمی دهد - یعنی با وانمود کردن اینکه مقدار مول محلول مجموع مقادیر مول دو ماده است.
دامنه حلالیت به طور گسترده ای متغیر است، از بی نهایت محلول (بدون حد، یعنی قابل امتزاج [2] ) مانند اتانول در آب تا اساسا نامحلول، مانند دی اکسید تیتانیوم در آب. تعدادی از اصطلاحات توصیفی دیگر نیز برای تعیین میزان حلالیت برای یک کاربرد معین استفاده می شود. به عنوان مثال، فارماکوپه ایالات متحده، با توجه به جرم m sv حلال مورد نیاز برای حل کردن یک واحد جرم m su از املاح، شرایط زیر را ارائه می دهد: [8] (حلالیت مثال ها تقریبی است، برای آب در دمای 20-25 درجه سانتی گراد .)
آستانه برای توصیف چیزی به عنوان نامحلول یا اصطلاحات مشابه، ممکن است به کاربرد بستگی داشته باشد. به عنوان مثال، یک منبع بیان می کند که مواد زمانی به عنوان "نامحلول" توصیف می شوند که حلالیت آنها کمتر از 0.1 گرم در 100 میلی لیتر حلال باشد. [9]
حلالیت در تعادل دینامیکی رخ می دهد، به این معنی که حلالیت از فرآیندهای همزمان و متضاد انحلال و اتصال فاز (مثلاً رسوب جامدات ) ناشی می شود. حالت پایدار تعادل حلالیت زمانی رخ می دهد که سرعت انحلال و اتصال مجدد برابر باشد، به این معنی که مقادیر نسبی مواد محلول و غیر محلول برابر باشد. اگر حلال حذف شود، تمام ماده ای که حل شده بود بازیابی می شود.
اصطلاح حلالیت نیز در برخی از زمینه ها استفاده می شود که در آن املاح با حلولیز تغییر می یابد . به عنوان مثال، گفته می شود که بسیاری از فلزات و اکسیدهای آنها "محلول در اسید کلریدریک" هستند، اگرچه در واقع اسید آبی به طور برگشت ناپذیری جامد را تجزیه می کند و محصولات محلول می دهد. اکثر جامدات یونی وقتی در حلال های قطبی حل می شوند، تجزیه می شوند. در مواردی که املاح با تبخیر حلال بازیافت نمی شود، این فرآیند به عنوان حلالیز نامیده می شود. مفهوم ترمودینامیکی حلالیت به طور مستقیم در حلالیز کاربرد ندارد.
هنگامی که یک املاح حل می شود، ممکن است چندین گونه در محلول تشکیل شود. به عنوان مثال، محلول آبی کلرید کبالت (II) می تواند [Co(H 2 O) 6 ] 2+ , [CoCl(H 2 O) 5 ] + , CoCl 2 (H 2 O) 2 را ایجاد کند که هر کدام به یکدیگر تبدیل می شوند. .
حلالیت برای فازهای خاص تعریف شده است . به عنوان مثال، انتظار می رود که حلالیت آراگونیت و کلسیت در آب متفاوت باشد، حتی اگر هر دو چند شکلی از کربنات کلسیم باشند و فرمول شیمیایی یکسانی داشته باشند . [ توضیح لازم است ]
حلالیت یک ماده در ماده دیگر با تعادل نیروهای بین مولکولی بین حلال و املاح و تغییر آنتروپی که حلالیت را همراهی می کند تعیین می شود. عواملی مانند دما و فشار این تعادل را تغییر می دهند و در نتیجه حلالیت را تغییر می دهند.
حلالیت همچنین ممکن است به شدت به حضور گونه های دیگر محلول در حلال بستگی داشته باشد، به عنوان مثال، آنیون های تشکیل دهنده پیچیده ( لیگاندها ) در مایعات. حلالیت همچنین به کمبود یا زیاد بودن یک یون مشترک در محلول بستگی دارد [ شفاف سازی لازم است ] ، پدیده ای که به عنوان اثر یون مشترک شناخته می شود . تا حدی کمتر، حلالیت به قدرت یونی محلول ها بستگی دارد. دو اثر آخر را می توان با استفاده از معادله تعادل حلالیت اندازه گیری کرد .
برای جامدی که در یک واکنش ردوکس حل می شود، انتظار می رود حلالیت به پتانسیل بستگی داشته باشد (در محدوده پتانسیل هایی که جامد تحت آن فاز پایدار ترمودینامیکی باقی می ماند). به عنوان مثال، حلالیت طلا در آب با دمای بالا تقریباً یک مرتبه بزرگتر (یعنی حدود ده برابر بیشتر) مشاهده می شود که پتانسیل اکسیداسیون و کاهش با استفاده از بافر ردوکس Fe 3 O 4 -Fe 2 O 3 بسیار اکسید کننده کنترل شود. با یک بافر اکسید کننده متوسط Ni - NiO . [10]

حلالیت (دیگر پایداری، در غلظت های نزدیک به اشباع) همچنین به اندازه فیزیکی کریستال یا قطره املاح (یا به بیان دقیق، به سطح خاص یا سطح مولی ماده حل شده) بستگی دارد. [11] برای تعیین کمیت، به معادله در مقاله تعادل حلالیت مراجعه کنید . برای کریستال های بسیار معیوب، حلالیت ممکن است با افزایش درجه بی نظمی افزایش یابد. هر دوی این اثرات به دلیل وابستگی ثابت حلالیت به انرژی گیبس کریستال رخ می دهند. دو اثر آخر، اگرچه اندازهگیری اغلب دشوار است، اما اهمیت عملی دارند. [ نیاز به منبع ] برای مثال، آنها نیروی محرکه برای پیری رسوبی را فراهم می کنند (اندازه کریستال به طور خود به خود با گذشت زمان افزایش می یابد).
حلالیت یک املاح معین در یک حلال معین تابع دما است. بسته به تغییر در آنتالپی (Δ H ) واکنش انحلال، به عنوان مثال ، در ویژگی گرماگیر (Δ H > 0) یا گرمازا (Δ H < 0) واکنش انحلال، حلالیت یک ترکیب معین ممکن است افزایش یا کاهش یابد. با دما معادله van't Hoff تغییر ثابت تعادل حلالیت ( K sp ) را به تغییر دما و به تغییر آنتالپی واکنش مرتبط میکند . برای اکثر جامدات و مایعات، حلالیت آنها با دما افزایش می یابد زیرا واکنش انحلال آنها گرماگیر است (ΔH > 0). [12] در آب مایع در دماهای بالا، (به عنوان مثال نزدیک شدن به دمای بحرانی )، حلالیت املاح یونی به دلیل تغییر خواص و ساختار آب مایع، تمایل به کاهش دارد. ثابت دی الکتریک پایین منجر به حلال قطبی کمتر و تغییر انرژی هیدراتاسیون می شود که بر ΔG واکنش انحلال تأثیر می گذارد .
املاح گازی رفتار پیچیده تری با دما از خود نشان می دهند. با افزایش دما، گازها معمولا کمتر در آب حل می شوند (واکنش انحلال گرمازا مربوط به هیدراتاسیون آنها) (به حداقل می رسد که برای اکثر گازهای دائمی زیر 120 درجه سانتیگراد است [13] )، اما در حلال های آلی حلال تر می شوند (گرماداز). واکنش انحلال مربوط به حلالیت آنها). [12]
نمودار منحنیهای حلالیت برخی نمکهای معدنی جامد معمولی را در آب مایع نشان میدهد (دما بر حسب درجه سانتیگراد است ، یعنی کلوین منهای 273.15). [14] بسیاری از نمک ها مانند نیترات باریم و دی سدیم هیدروژن آرسنات رفتار می کنند و افزایش زیادی در حلالیت با دما نشان می دهند (ΔH > 0). برخی از املاح (مثلاً کلرید سدیم در آب) حلالیت نسبتاً مستقلی از دما نشان می دهند (Δ H ≈ 0). تعداد کمی مانند سولفات کلسیم ( گچ ) و سولفات سریم (III) با افزایش دما کمتر در آب حل می شوند (ΔH < 0). [15] این مورد برای هیدروکسید کلسیم ( پورتلندیت ) نیز صادق است، که حلالیت آن در 70 درجه سانتیگراد حدود نیمی از مقدار آن در 25 درجه سانتیگراد است. انحلال هیدروکسید کلسیم در آب نیز یک فرآیند گرمازا است (ΔH < 0). همانطور که توسط معادله van't Hoff و اصل Le Chatelier دیکته می شود ، دمای پایین به انحلال Ca(OH) 2 کمک می کند . حلالیت پرتلندیت در دمای پایین افزایش می یابد. این وابستگی به دما گاهی اوقات به عنوان حلالیت «پسرونده» یا «معکوس» نامیده میشود. [ نیاز به ذکر منبع ] گاهی اوقات، الگوی پیچیدهتری مشاهده میشود، مانند سولفات سدیم ، که در آن کریستال هیدرات دکا ( میرابیلیت ) آب تبلور کمتری را در دمای 32 درجه سانتیگراد از دست میدهد تا فاز بیآب محلولتری ( تناردیت ) با تغییر کوچکتر تشکیل دهد. در انرژی آزاد گیبس (Δ G ) در واکنش انحلال. [ نیازمند منبع ]
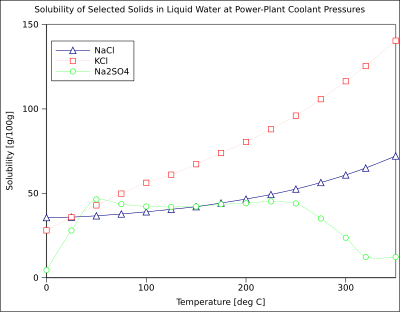
حلالیت ترکیبات آلی تقریباً همیشه با دما افزایش می یابد. تکنیک تبلور مجدد ، که برای خالص سازی جامدات استفاده می شود، به حلالیت های مختلف یک املاح در حلال سرد و گرم بستگی دارد. چند استثنا وجود دارد، مانند سیکلودکسترین های خاص . [16]
برای فازهای متراکم (جامدات و مایعات)، وابستگی به فشار حلالیت معمولاً ضعیف است و معمولاً در عمل نادیده گرفته میشود. با فرض یک راه حل ایده آل ، وابستگی را می توان به صورت کمی محاسبه کرد:
در جایی که شاخص اجزاء را تکرار می کند، کسر مولی امین جزء در محلول است، فشار است، شاخص به دمای ثابت اشاره دارد، حجم مولی جزئی امین جزء در محلول است ، حجم مولی جزئی است. جزء -امین ماده جامد در حال حل است و ثابت گاز جهانی است . [17]
وابستگی به فشار حلالیت گاهی اوقات اهمیت عملی دارد. به عنوان مثال، رسوب گیری میادین نفتی و چاه ها توسط سولفات کلسیم (که حلالیت آن را با کاهش فشار کاهش می دهد) می تواند منجر به کاهش بهره وری در طول زمان شود.
از قانون هنری برای تعیین کمیت حلالیت گازها در حلال ها استفاده می شود. حلالیت گاز در یک حلال با فشار جزئی آن گاز در بالای حلال نسبت مستقیم دارد. این رابطه مشابه قانون رائول است و می توان آن را به صورت زیر نوشت:
که در آن یک ثابت وابسته به دما (به عنوان مثال، 769.2 L · اتمسفر / مول برای دی اکسیژن (O 2 ) در آب در 298 K)، فشار جزئی (در اتمسفر)، و غلظت گاز محلول در مایع است . (در مول در لیتر).
حلالیت گازها گاهی اوقات با استفاده از ضریب حلالیت بونسن نیز تعیین می شود .
در حضور حباب های کوچک ، حلالیت گاز به شعاع حباب به هیچ وجه به شعاع حباب بستگی ندارد به غیر از اثر شعاع بر فشار (یعنی حلالیت گاز در مایع در تماس با حباب های کوچک افزایش می یابد. افزایش فشار با Δ p = 2γ/ r به معادله یانگ-لاپلاس مراجعه کنید . [18]
قانون هانری برای گازهایی که در زمان انحلال دچار تغییر گونه زایی شیمیایی نمی شوند معتبر است. قانون سیورتس موردی را نشان می دهد که این فرض صادق نیست.
حلالیت دی اکسید کربن در آب دریا نیز تحت تأثیر دما، pH محلول و بافر کربنات است . کاهش حلالیت دی اکسید کربن در آب دریا هنگام افزایش دما نیز یک فاکتور مهم پسرفت (بازخورد مثبت) است که تغییرات آب و هوایی گذشته و آینده را تشدید می کند همانطور که در هسته های یخی از سایت Vostok در قطب جنوب مشاهده شد . در مقیاس زمانی زمین شناسی ، به دلیل چرخه های میلانکوویچ ، زمانی که پارامترهای نجومی مدار زمین و محور چرخش آن به تدریج تغییر می کند و تابش خورشید در سطح زمین را تغییر می دهد، دما شروع به افزایش می کند. هنگامی که یک دوره یخ زدایی آغاز می شود، گرم شدن تدریجی اقیانوس ها CO2 را به اتمسفر آزاد می کند زیرا حلالیت کمتری در آب گرمتر دریا دارد. به نوبه خود، سطوح بالاتر CO 2 در جو باعث افزایش اثر گلخانه ای می شود و دی اکسید کربن به عنوان تقویت کننده گرمایش عمومی عمل می کند.
یک قصار رایج که برای پیشبینی حلالیت استفاده میشود، « مثل حل میشود » است که در زبان لاتین به عنوان « Similia similibus Solntur » نیز بیان میشود. [19] این عبارت نشان می دهد که یک املاح در حلالی که ساختار شیمیایی مشابهی با خودش دارد، بر اساس آنتروپی مطلوب اختلاط ، به بهترین وجه حل می شود . این دیدگاه ساده انگارانه است، اما یک قانون کلی مفید است. ظرفیت حلالیت کلی یک حلال در درجه اول به قطبیت آن بستگی دارد . [a] به عنوان مثال، یک املاح بسیار قطبی ( آب دوست ) مانند اوره در آب بسیار قطبی بسیار محلول است، در متانول نسبتاً قطبی کمتر محلول است و عملاً در حلال های غیر قطبی مانند بنزن نامحلول است . در مقابل، یک املاح غیر قطبی یا چربی دوست مانند نفتالین در آب نامحلول، در متانول نسبتاً محلول و در بنزن غیر قطبی بسیار محلول است. [20]
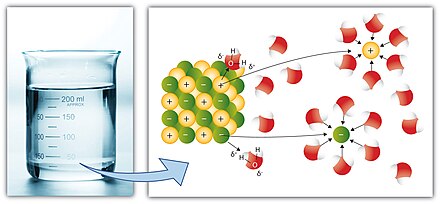
به عبارت ساده تر، یک ترکیب یونی ساده (با یون های مثبت و منفی) مانند کلرید سدیم (نمک معمولی) به راحتی در یک حلال بسیار قطبی (با مقداری جداسازی بارهای مثبت (δ+) و منفی (δ-) حل می شود. مولکول کووالانسی) مانند آب ، زیرا دریا شور است زیرا نمک های محلول را از دوران اولیه زمین شناسی جمع می کند.
حلالیت توسط آنتروپی اختلاط (ΔS ) مورد علاقه است و به آنتالپی انحلال (ΔH ) و اثر آبگریز بستگی دارد . انرژی آزاد انحلال ( انرژی گیبس ) به دما بستگی دارد و با رابطه: Δ G = Δ H – TΔ S داده می شود . Δ G کوچکتر به معنای حلالیت بیشتر است.
شیمیدانها اغلب از تفاوتها در حلالیتها برای جداسازی و خالصسازی ترکیبات از مخلوطهای واکنش، با استفاده از تکنیک استخراج مایع-مایع استفاده میکنند . این امر در حوزه های وسیعی از شیمی از سنتز دارو تا پردازش مجدد سوخت هسته ای مصرف شده اعمال می شود .
انحلال یک فرآیند آنی نیست. میزان انحلال (بر حسب کیلوگرم بر ثانیه) به محصول حلالیت و مساحت سطح ماده مربوط می شود. سرعت حل شدن یک جامد ممکن است در مورد جامدات آمورف و مساحت سطح (اندازه کریستال) و وجود چندشکلی به کریستالی بودن یا نبود آن بستگی داشته باشد . بسیاری از سیستم های عملی این اثر را نشان می دهند، به عنوان مثال در طراحی روش هایی برای تحویل کنترل شده دارو . در برخی موارد، برقراری تعادل انحلالپذیری میتواند زمان زیادی طول بکشد (ساعتها، روزها، ماهها یا سالها؛ بسته به ماهیت املاح و عوامل دیگر).
سرعت انحلال را می توان اغلب با معادله نویز-ویتنی یا معادله نرنست و برونر [21] به شکل زیر بیان کرد:
کجا:
برای انحلال محدود شده توسط انتشار (یا انتقال جرم در صورت اختلاط) برابر است با حلالیت ماده. هنگامی که سرعت انحلال یک ماده خالص به سطح جامد نرمال می شود (که معمولاً در طول فرآیند انحلال با زمان تغییر می کند)، آنگاه آن را بر حسب کیلوگرم بر مترمربع بر ثانیه بیان می کنند و به عنوان "نرخ انحلال ذاتی" نامیده می شود. نرخ انحلال ذاتی توسط داروسازی ایالات متحده تعریف شده است .
نرخ انحلال بر اساس مرتبه های بزرگی بین سیستم های مختلف متفاوت است. به طور معمول، نرخ انحلال بسیار پایین موازی با انحلال پذیری کم، و مواد با انحلال بالا نشان می دهد نرخ انحلال بالا، همانطور که توسط معادله Noyes-Whitney پیشنهاد شده است.
ثابت حلالیت برای توصیف محلول های اشباع ترکیبات یونی با حلالیت نسبتا کم استفاده می شود (به تعادل حلالیت مراجعه کنید ). ثابت حلالیت حالت خاصی از ثابت تعادل است . از آنجایی که محصول غلظت یون در حالت تعادل است، به عنوان محصول حلالیت نیز شناخته می شود . تعادل بین یون های محلول نمک و نمک حل نشده را توصیف می کند. ثابت حلالیت نیز برای رسوب «قابل اجرا» (یعنی مفید) است ، برعکس واکنش انحلال. مانند سایر ثابت های تعادل، دما می تواند بر مقدار عددی ثابت حلالیت تأثیر بگذارد. در حالی که ثابت حلالیت به سادگی حلالیت نیست، مقدار این ثابت به طور کلی مستقل از حضور گونه های دیگر در حلال است.
نظریه محلول فلوری-هاگینز یک مدل نظری است که حلالیت پلیمرها را توصیف می کند. پارامترهای حلالیت هانسن و پارامترهای حلالیت هیلدبراند روشهای تجربی برای پیشبینی حلالیت هستند. همچنین می توان حلالیت را از دیگر ثابت های فیزیکی مانند آنتالپی همجوشی پیش بینی کرد .
ضریب تقسیم اکتانول-آب که معمولاً به صورت لگاریتم آن (Log P) بیان میشود، معیاری از حلالیت تفاضلی یک ترکیب در یک حلال آبگریز ( 1-اکتانول ) و یک حلال آبدوست (آب) است. لگاریتم این دو مقدار ترکیبات را قادر می سازد تا از نظر آب دوستی (یا آبگریزی) رتبه بندی شوند.
تغییر انرژی مرتبط با انحلال معمولا به ازای هر مول از املاح به عنوان آنتالپی محلول داده می شود .
حلالیت در تعداد زیادی از رشته های علمی و کاربردهای عملی، از فرآوری سنگ معدن و بازفرآوری هسته ای گرفته تا استفاده از داروها و انتقال آلاینده ها، از اهمیت اساسی برخوردار است.
حلالیت اغلب به عنوان یکی از "خواص مشخصه یک ماده" گفته می شود، به این معنی که حلالیت معمولاً برای توصیف ماده، نشان دادن قطبیت یک ماده، کمک به تشخیص آن از سایر مواد و به عنوان راهنمای کاربردها استفاده می شود. از ماده به عنوان مثال، نیل به عنوان "نامحلول در آب، الکل یا اتر اما محلول در کلروفرم، نیتروبنزن، یا اسید سولفوریک غلیظ " توصیف می شود. [22]
حلالیت یک ماده هنگام جداسازی مخلوط ها مفید است. به عنوان مثال، مخلوطی از نمک ( کلرید سدیم ) و سیلیس ممکن است با حل کردن نمک در آب و فیلتر کردن سیلیس حل نشده جدا شود. سنتز ترکیبات شیمیایی، به میزان میلی گرم در آزمایشگاه، یا بر حسب تن در صنعت، هر دو از حلالیت نسبی محصول مورد نظر و همچنین از مواد اولیه واکنش نداده، محصولات جانبی و محصولات جانبی برای دستیابی به جداسازی استفاده می کنند.
نمونه دیگری از این سنتز اسید بنزوئیک از برومید فنیل منیزیم و یخ خشک است . اسید بنزوئیک در یک حلال آلی مانند دی کلرومتان یا دی اتیل اتر محلول تر است و وقتی با این حلال آلی در یک قیف جداکننده تکان داده شود ترجیحاً در لایه آلی حل می شود. سایر محصولات واکنش، از جمله برومید منیزیم، در لایه آبی باقی می مانند، که به وضوح نشان می دهد که جداسازی بر اساس حلالیت حاصل شده است. این فرآیند که به عنوان استخراج مایع- مایع شناخته می شود ، یک تکنیک مهم در شیمی مصنوعی است . بازیافت برای اطمینان از حداکثر استخراج استفاده می شود.
در سیستمهای جاری، تفاوت در حلالیت اغلب تعیینکننده حمل و نقل ناشی از انحلال-بارش گونهها است. این زمانی اتفاق می افتد که بخش های مختلف سیستم شرایط متفاوتی را تجربه کنند. با توجه به زمان کافی، حتی شرایط کمی متفاوت می تواند اثرات قابل توجهی داشته باشد.
به عنوان مثال، ترکیبات با حلالیت نسبتاً کم در محیطهای شدیدتر محلول هستند که منجر به اثرات ژئوشیمیایی و زمینشناسی فعالیت سیالات گرمابی در پوسته زمین میشود. اینها اغلب منبع ذخایر معدنی اقتصادی با کیفیت بالا و جواهرات گرانبها یا نیمه قیمتی هستند. به همین ترتیب، ترکیبات با حلالیت کم در طول زمان طولانی (زمان زمینشناسی) حل میشوند که منجر به اثرات قابل توجهی مانند سیستمهای غار گسترده یا سطوح زمین کارستی میشود.
برخی از ترکیبات یونی ( نمک ها ) در آب حل می شوند که به دلیل جاذبه بین بارهای مثبت و منفی ایجاد می شود (نگاه کنید به: حلالیت ). به عنوان مثال، یون های مثبت نمک (به عنوان مثال Ag + ) اتم اکسیژن نیمه منفی در H 2 O را جذب می کنند . به همین ترتیب، یون های منفی نمک (به عنوان مثال Cl- ) هیدروژن های تا حدی مثبت موجود در H 2 O را جذب می کنند . توجه: اتم اکسیژن تا حدی منفی است زیرا الکترونگاتیوتر از هیدروژن است و بالعکس (نگاه کنید به: قطبیت شیمیایی ).
با این حال، محدودیتی برای میزان نمک قابل حل در حجم معینی از آب وجود دارد. این غلظت حلالیت و مربوط به محصول حلالیت K sp است . این ثابت تعادل به نوع نمک ( برای مثال AgCl در مقابل NaCl )، دما و اثر یون مشترک بستگی دارد.
می توان مقدار AgCl را که در 1 لیتر آب خالص حل می شود به صورت زیر محاسبه کرد:
[Ag + ] = [Cl- ] ، در غیاب سایر نمک های نقره یا کلرید، بنابراین
نتیجه: 1 لیتر آب می تواند 1.34 × 10-5 مول AgCl را در دمای اتاق حل کند. در مقایسه با سایر نمک ها، AgCl در آب محلول کمی است. به عنوان مثال، نمک خوراکی ( NaCl) دارای Ksp = 36 بسیار بالاتر است و بنابراین محلول تر است. جدول زیر یک نمای کلی از قوانین حلالیت برای ترکیبات یونی مختلف ارائه می دهد.
اصل ذکر شده در بالا تحت قطبیت، که مشابه حل می شود ، راهنمای معمول حلالیت در سیستم های آلی است. به عنوان مثال، ژله نفتی در بنزین حل می شود زیرا هر دو وازلین و بنزین هیدروکربن های غیر قطبی هستند. از طرف دیگر، در اتیل الکل یا آب حل نمی شود ، زیرا قطبیت این حلال ها بسیار زیاد است. شکر در بنزین حل نمی شود، زیرا شکر در مقایسه با بنزین بسیار قطبی است. بنابراین مخلوطی از بنزین و شکر را می توان با فیلتر کردن یا استخراج با آب جدا کرد.
این اصطلاح اغلب در زمینه متالورژی برای اشاره به میزان حل شدن یک عنصر آلیاژی در فلز پایه بدون تشکیل فاز جداگانه استفاده می شود . solvus یا خط (یا منحنی) حلالیت ، خط (یا خطوط) در نمودار فاز است که محدودیتهای اضافه کردن املاح را نشان میدهد. یعنی خطوط حداکثر مقدار یک جزء را نشان می دهد که می تواند به جزء دیگر اضافه شود و همچنان در محلول جامد باشد . در ساختار کریستالی جامد، عنصر «املاح» میتواند جای ماتریس را در شبکه بگیرد (موقعیت جایگزینی؛ به عنوان مثال، کروم در آهن) یا در فضایی بین نقاط شبکه (موقعیت بینابینی). برای مثال کربن موجود در آهن).
در ساخت میکروالکترونیک، حلالیت جامد به حداکثر غلظت ناخالصی هایی که می توان در بستر قرار داد اشاره دارد.
در ترکیبات جامد (بر خلاف عناصر)، حلالیت یک عنصر املاح می تواند به فازهایی که در حالت تعادل از هم جدا می شوند نیز بستگی داشته باشد. به عنوان مثال، مقدار Sn محلول در فاز ZnSb می تواند به طور قابل توجهی به این بستگی داشته باشد که فازهایی که در حالت تعادل از هم جدا می شوند (Zn 4 Sb 3 + Sn (L)) یا (ZnSnSb 2 + Sn (L)). [24] علاوه بر اینها، ترکیب ZnSb با Sn به عنوان یک املاح می تواند پس از رسیدن به حد حلالیت بسته به ترکیب شیمیایی اولیه در طول سنتز، به ترکیبات دیگر فازها جدا شود . هر ترکیب حلالیت متفاوتی از Sn در ZnSb ایجاد می کند. از این رو مطالعات حلالیت در ترکیبات، که در اولین نمونه از مشاهده فازهای ثانویه جدا شده به نتیجه رسیدند، ممکن است حلالیت را دست کم بگیرند. [25] در حالی که حداکثر تعداد فازهایی که به طور همزمان در حالت تعادل از هم جدا می شوند را می توان با قانون فاز گیب تعیین کرد ، برای ترکیبات شیمیایی محدودیتی در تعداد این ترکیبات جداکننده فاز وجود ندارد. از این رو، ایجاد "حداکثر انحلال پذیری" در ترکیبات جامد به صورت تجربی می تواند دشوار باشد و به تعادل بسیاری از نمونه ها نیاز دارد. اگر نقص کریستالوگرافی غالب (عمدتاً عیوب نقطه بینابینی یا جانشینی) درگیر در محلول جامد را بتوان از قبل به صورت شیمیایی تشخیص داد، آنگاه با استفاده از برخی دستورالعملهای ترمودینامیکی ساده میتوان تعداد نمونههای مورد نیاز برای ایجاد حداکثر حلالیت را به میزان قابل توجهی کاهش داد. [26]
بسیاری از مواد به طور متجانس حل می شوند (یعنی ترکیب جامد و املاح محلول از نظر استوکیومتری مطابقت دارند). با این حال، برخی از مواد ممکن است به طور نامتجانس حل شوند ، به طوری که ترکیب املاح در محلول با ترکیب جامد مطابقت ندارد. این انحلال با تغییر "جامد اولیه" و احتمالاً تشکیل یک فاز جامد ثانویه همراه است. با این حال، به طور کلی، مقداری جامد اولیه نیز باقی می ماند و یک تعادل حلالیت پیچیده برقرار می شود. به عنوان مثال، انحلال آلبیت ممکن است منجر به تشکیل گیبسیت شود . [27]
در این مورد انتظار می رود که حلالیت آلبیت به نسبت جامد به حلال بستگی داشته باشد. این نوع حلالیت در زمین شناسی اهمیت زیادی دارد، جایی که منجر به تشکیل سنگ های دگرگونی می شود .
در اصل، انحلال متجانس و ناهمگون می تواند منجر به تشکیل فازهای جامد ثانویه در حالت تعادل شود. بنابراین، در زمینه علم مواد ، حلالیت برای هر دو مورد به طور کلی در نمودارهای فاز ترکیب شیمیایی توضیح داده شده است .
حلالیت یک ویژگی مورد علاقه در بسیاری از جنبه های علم است، از جمله اما نه محدود به: پیش بینی های محیطی، بیوشیمی، داروسازی، طراحی دارو، طراحی شیمیایی کشاورزی، و اتصال لیگاند پروتئین. حلالیت در آب به دلیل عملکردهای بیولوژیکی و حمل و نقل حیاتی که توسط آب انجام می شود از اهمیت اساسی برخوردار است. [28] [29] [30] علاوه بر این، به این علاقه علمی واضح به حلالیت در آب و اثرات حلال. پیش بینی دقیق حلالیت از نظر صنعتی مهم است. توانایی پیشبینی دقیق حلالیت یک مولکول نشاندهنده صرفهجویی مالی بالقوه زیادی در بسیاری از فرآیندهای توسعه محصولات شیمیایی، مانند داروسازی است. [31] در صنعت داروسازی، پیشبینیهای حلالیت بخشی از مراحل اولیه بهینهسازی سرب در کاندیداهای دارو را تشکیل میدهند. حلالیت تا زمان فرمولاسیون یک نگرانی باقی می ماند. [31] تعدادی از روشها برای چنین پیشبینیهایی از جمله روابط ساختار-فعالیت کمی (QSAR)، روابط کمی ساختار-ویژگی (QSPR) و داده کاوی استفاده شده است . این مدل ها پیش بینی های کارآمد حلالیت را ارائه می دهند و استاندارد فعلی را نشان می دهند. نقطه ضعف چنین مدل هایی این است که آنها بینش فیزیکی ندارند. روشی که در تئوری فیزیکی پایه گذاری شده و قادر به دستیابی به سطوح مشابهی از دقت با هزینه معقول باشد، از نظر علمی و صنعتی ابزار قدرتمندی خواهد بود. [32] [33] [34] [35]
روشهای پایهگذاری شده در تئوری فیزیکی تمایل دارند از چرخههای ترمودینامیکی استفاده کنند، مفهومی از ترمودینامیک کلاسیک . دو چرخه متداول ترمودینامیکی مورد استفاده شامل محاسبه انرژی آزاد تصعید (جامد به گاز بدون عبور از حالت مایع) و انرژی آزاد حلال شدن یک مولکول گازی (گاز به محلول) یا انرژی آزاد همجوشی (جامد) است. به فاز مذاب) و انرژی آزاد اختلاط (مذاب به محلول). این دو فرآیند در نمودارهای زیر نشان داده شده است.


این چرخه ها برای تلاش برای پیش بینی اصول اولیه (حل با استفاده از معادلات فیزیکی اساسی) با استفاده از مدل های حلال با انگیزه فیزیکی ، [33] برای ایجاد معادلات پارامتری و مدل های QSPR [36] [34] و ترکیبی از این دو مورد استفاده قرار گرفته اند. [34] استفاده از این چرخه ها محاسبه انرژی آزاد حلالیت را به طور غیر مستقیم از طریق گاز (در چرخه تصعید) یا مذاب (چرخه همجوشی) امکان پذیر می کند. این مفید است زیرا محاسبه انرژی آزاد حلالیت به طور مستقیم بسیار دشوار است. انرژی آزاد حلالپذیری را میتوان با استفاده از فرمولهای مختلف به مقدار حلالیت تبدیل کرد، کلیترین حالت در زیر نشان داده شده است، که در آن صورتگر انرژی آزاد حلپذیری، R ثابت گاز و T دما بر حسب کلوین است . [33]
معادلات برازش شناخته شده برای پیش بینی حلالیت معادلات حلالیت عمومی هستند. این معادلات ناشی از کار یالکوفسکی و همکاران است . [37] [38] ابتدا فرمول اصلی ارائه میشود و پس از آن یک فرمول تجدیدنظر شده که فرض متفاوتی از اختلاط کامل در اکتانول دارد. [38]
این معادلات بر اساس اصول چرخه همجوشی است.